
【题目】在高温高压下碳氧化物具有极高的化学活性,能与多种单质或化合物反应。
(1)一定条件下,CO与H2 可合成甲烷,反应方程式为:CO(g)+3H2(g) ![]() CH4(g)+ H2O(g)
CH4(g)+ H2O(g)
①一定条件下,该反应能够自发进行的原因是_________
②已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8kJ/mol 283.0kJ/mol和890.0kJ/mol。
写出CO 与H2 反应生成CH4 和CO2 的热化学方程式:_____________。
(2)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO (g) +2H2 (g) ![]() CH3OH (g)
CH3OH (g)
反应Ⅱ: CO2 (g) +3H2 (g) ![]() CH3OH (g) +H2O (g)
CH3OH (g) +H2O (g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为______________。
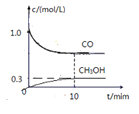
②一定温度下,在体积可变的密闭容器中加入4molH2和一定量的CO发生反应Ⅰ,开始时容器体积为2L,CO 和CH3OH (g) 的浓度随时可变化如图。10min 达到平衡,则反应1的化学平衡常数为____________。
③恒温恒容条件下,在密闭容器中等物质的量的通入CO2 和H2, 下列描述能说明反应Ⅱ已经达到平衡状态的是___。(填标号)
A.容器内CO2的体积分数不再变化
B.当CO2和H2转化率的比值不再变化
C.单位时间CH3OH分子断裂5NA个共价键,同时断裂3NA个H-H键
D.容器内混合气体的平均相对分子质量为34.5,且保持不变
(3)甲烷碱性燃料电池装置如图所示(开始时两边溶液质量相等),用电器为惰性电极电解装置,其原理是:通电后,将Co2+氧化成Co3+,进而彻底氧化CN-为无害气体使废水得以净化。
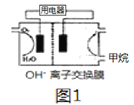
①当除去1molCN-时,图1两边质量差为__________g.
②负极电极反应式为__________.
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g) ΔH=-29.1KJ/mol,科研人员对该反应进行了研究.部分研究结果如下:
HCOOCH3(g) ΔH=-29.1KJ/mol,科研人员对该反应进行了研究.部分研究结果如下:
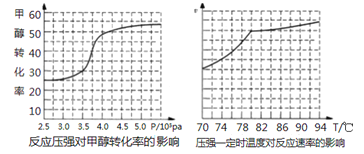
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是_____。
②实际工业生产中采用的温度是80℃,其理由是___________。
【答案】 该反应ΔH <0 2CO (g)+2H2(g) ![]() CH4(g)+CO2(g)ΔH=-247.6kJ/mol 反应I符合“原了经济性”的原则即原了利用率为100% 25/243 ABCD 140g CH4+ 10OH+-8e-=CO32-+7H2O 4.0×106Pa 高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低
CH4(g)+CO2(g)ΔH=-247.6kJ/mol 反应I符合“原了经济性”的原则即原了利用率为100% 25/243 ABCD 140g CH4+ 10OH+-8e-=CO32-+7H2O 4.0×106Pa 高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低
【解析】本题主要考查有关化学平衡的判断和计算。
(1)①一定条件下,反应能够自发进行,△H–T△S<0,该反应△S<0,所以该反应能够自发进行的原因是△H<0。
②由H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和890.0kJ/mol得2H2(g) +O2(g)![]() 2H2O(l)ΔH=-571.6kJ/mol,2CO(g)+O2(g)
2H2O(l)ΔH=-571.6kJ/mol,2CO(g)+O2(g)![]() 2CO2(g)ΔH=-566kJ/mol,CO2(g)+2H2O(l)
2CO2(g)ΔH=-566kJ/mol,CO2(g)+2H2O(l)![]() CH4(g)+2O2(g)ΔH=+890.0kJ/mol,将以上3个热化学方程式相加可得CO与H2反应生成CH4和CO2的热化学方程式:2CO(g)+2H2(g)
CH4(g)+2O2(g)ΔH=+890.0kJ/mol,将以上3个热化学方程式相加可得CO与H2反应生成CH4和CO2的热化学方程式:2CO(g)+2H2(g)![]() CH4(g)+CO2(g)ΔH=-247.6kJ/mol。
CH4(g)+CO2(g)ΔH=-247.6kJ/mol。
(2)①在以上制备甲醇的两个反应中,反应Ⅰ优于反应Ⅱ,原因为反应I符合“原了经济性”的原则即原子利用率为100%。
②开始时,c(CO)=1.0mol/L,所以n(CO)=2mol,设容器平衡体积为VL,定温定压,气体物质的量之比等于体积之比,6:(6-0.6V)=2:V,V=![]() 。
。
平衡时,c(CH3OH)=0.3mol/L,n(CH3OH)=0.3×![]() mol=0.5mol,c(CO)=(2-0.5)×
mol=0.5mol,c(CO)=(2-0.5)×![]() mol/L=0.9mol/L,c(H2)=(4-1)×
mol/L=0.9mol/L,c(H2)=(4-1)×![]() mol/L=1.8mol/L,则反应1的化学平衡常数为
mol/L=1.8mol/L,则反应1的化学平衡常数为![]() =
=![]() 。
。
③A.容器内CO2的体积分数随着反应进行而变化,当容器内CO2的体积分数不再变化时,反应达到平衡状态,故A能说明反应Ⅱ已经达到平衡状态;B. CO2和H2的配比不等于化学计量数之比,CO2和H2转化率的比值随着反应进行而变化,当CO2和H2转化率的比值不再变化,反应达到平衡状态,故B能说明反应Ⅱ已经达到平衡状态;C.单位时间CH3OH分子断裂5NA个共价键,有1molCH3OH参加反应,同时断裂3NA个H-H键,有3molH2参加反应,正反应速率等于逆反应速率,故C能说明反应Ⅱ已经达到平衡状态;D.容器内混合气体的质量守恒,物质的量随着反应进行而变化,混合气体的平均相对分子质量也随之变化,当混合气体的平均相对分子质量为34.5且保持不变时,反应达到平衡状态,故D能说明反应Ⅱ已经达到平衡状态。故选ABCD。
(3)①CN-被氧化为二氧化碳和氮气,5CH4~10O2~8CN-~8CO2~4N2~40e-~40OH/span>-(移动的),OH-由左向右移动,正极室溶液增加参加反应的氧气的质量,减少移动的OH-的质量,负极室溶液增加参加反应的甲烷的质量和移动的OH-的质量,图1两边质量差为(5×16+2×40×17-32×10)g/8=140g。
②负极电极反应式为CH4+10OH+-8e-=CO32-+7H2O。
(4)①从反应压强对甲醇转化率的影响“效率”看,压强大于4.0×106Pa时,转化率随压强增大提高很小,所以工业制取甲酸甲酯应选择的压强是4.0×106Pa。
②实际工业生产中采用的温度是80℃,其理由是高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低。


科目:高中化学 来源: 题型:
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
(1)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)=N2(g)+4H2O(g) △H=-1143 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
则2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=___________kJ·mol-1。
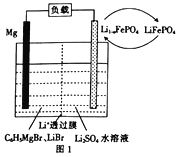
(2)一种镁一锂双离子二次电池的装置如图1所示。
①放电时, Mg 电 极 为___________ (填“ 正极”或“负极” ), Li +迁 移 至___________ (填“正极区”或“负极区”)。
②充电时,阳极的电极反应式为_______________________________。
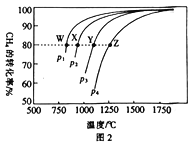
(3)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图2所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图2所示。
①图中p1、p2、p3、p4 代表不同压强,压强最大的是___________。该反应的△H___________(填“>"“<”或“=”下同)0。
②压强为p4时,在Y点:v(正)___________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、k3、K4由大到小的顾序为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)生成的黑色(单质)物质是__________ (填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是___________ (填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为:______________________________________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有__________(填序号)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(4)将实验②产生的刺激性气味气体通入品红溶液,可以看到品红溶液_________ 说明这种气体具有_____________________性;将②中产生的刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是在明矾溶液中滴入氢氧化钡溶液,下列说法错误的是( )

A. OA段的反应离子方程式为:2Al3++3SO![]() +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
B. AB段的离子方程式只有:Al(OH)3+OH-===AlO![]() +2H2O
+2H2O
C. A点的沉淀为Al(OH)3和BaSO4的混合物
D. B点溶液为KAlO2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如下(反应条件己略去):
已知:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O
2CuSO4+2H2O
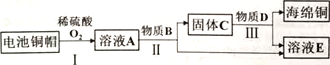
下列说法不正确的是
A. 过程II中分离操作的名称为过滤,该操作过程中使用到的玻璃仪器有烧杯、漏斗、玻璃棒
B. 溶液A中的溶质有H2SO4、CuSO4、ZnSO4
C. 上述流程中加入的物质B为锌,物质D为盐酸
D. AE中含铜、锌两种元素的物质有A和C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com