
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的原理及电池中发生的主要反应如图所示。下列说法正确的是( )
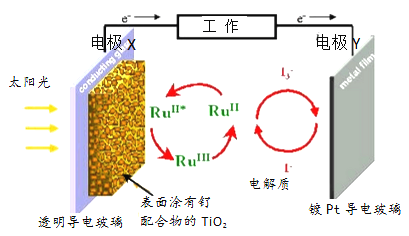
A. 镀铂导电玻璃的作用是传递I-
B. 电池工作时,光能转变为电能,X 为电池的正极
C. 电解质溶液中发生反应:2Ru3++3I-=2Ru2++I3-
D. 电池的电解质溶液中I-和I3-的浓度均不断减小
【答案】C
【解析】由图中电子的移动方向可知,电极X为原电池的负极,发生氧化反应,电极反应为:2Ru2+-2e-═2Ru3+,Y电极为原电池的正极,电解质为I3-和I-的混合物,I3-在正极上得电子被还原,正极反应为I3-+2e-=3I-。A、电池工作时,Y电极为原电池的正极,发生还原反应,则镀铂导电玻璃的作用是作正极材料,故A错误;B、由图中电子的移动方向可知,电极X为原电池的负极,故B错误;C、电池工作时,负极反应为:2Ru2+-2e-═2Ru3+,正极反应为I3-+2e-=3I-,又Ru2+和Ru3+,I3-和I-相互转化,所以电解质溶液中发生2Ru3++3I-═2Ru2++I3-,故C正确;D、由电池中发生的反应可知,I3-在正极上得电子被还原为3I-,后又被氧化为I3-,I3-和I-相互转化,反应的实质是光敏有机物在激发态与基态的相互转化,所有化学物质都没有被损耗,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】下列关于“物质的量”“摩尔”和“摩尔质量”的叙述正确的是
A. “物质的量”是国际单位制中的个基本单位
B. 1mol任何物质均约含有6.02×1023个分子
C. 物质的摩尔质量等于其相对分子质量或相对原子质量
D. 0.012kg12C中所含的碱原子数为NA(NA代表阿伏加德罗常数的数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中可逆反应mA(g)+nB(g) ![]() pC(g)+qQ(g) 当m、n、p、q为任意整数且C为有色物质,可逆反应一定达到平衡的标志是 ( )
pC(g)+qQ(g) 当m、n、p、q为任意整数且C为有色物质,可逆反应一定达到平衡的标志是 ( )
①混合气体的平均摩尔质量不再改变 ②体系的温度不再改变③各组分的浓度不再改变
④各组分的质量分数不再改变 ⑤反应速率VA:VB:VC:VQ=m:n:p:q ⑥体系颜色不再变化
⑦单位时间内m mol A断键反应,同时p mol C也断键反应
A. ②③④⑤⑥ B. ①②③④⑤ C. ②③④⑥⑦ D. ①②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
(1)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)=N2(g)+4H2O(g) △H=-1143 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
则2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=___________kJ·mol-1。
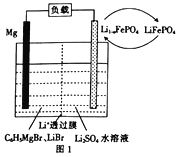
(2)一种镁一锂双离子二次电池的装置如图1所示。
①放电时, Mg 电 极 为___________ (填“ 正极”或“负极” ), Li +迁 移 至___________ (填“正极区”或“负极区”)。
②充电时,阳极的电极反应式为_______________________________。
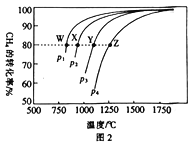
(3)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图2所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图2所示。
①图中p1、p2、p3、p4 代表不同压强,压强最大的是___________。该反应的△H___________(填“>"“<”或“=”下同)0。
②压强为p4时,在Y点:v(正)___________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、k3、K4由大到小的顾序为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。某探兖小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:

(1)仪器a的名称是______________。
(2)装置A中发生反应的离子方程式为____________________________________。
(3)仪器b中冷凝水从______(填“p”或“q”,下同)口进,___________口出。
(4)若撤去装置B,对实验的影响是__________________________________________________。
(5)实验时发现D中导管口处气泡速率过快,合理的解决方法是______________________。
(6)已知:CCl3CHO+OH-→CHCl3+HCOO-;HCOO-+I2-=H++2I-+CO2↑;I2+2S2O32-=2I-+S4O62-。称取0.40g产品,配成待测溶液,加入20.00mL0.100mol·L-1碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020mol·L-1的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。滴定时所用指示剂是__________________________,达到滴定终点的现象是_____________________________________________________,测得产品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A在酸性溶液中加热可发生如下反应,下列说法错误的是( ) 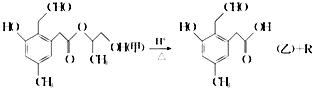
A.R为二元醇,不能发生银镜反应
B.1 mol甲在一定条件下与氢气反应,最多可消耗 5mol H2
C.甲在碱性条件下也可发生水解反应
D.甲和乙均能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃.某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去). 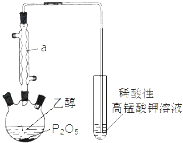
(1)仪器a的名称为 .
(2)用化学反应方程式表示上述制备乙烯的原理 .
(3)已知P2O5是一种酸性干燥剂,吸水放出大量热,在实验过程中P2O5与乙醇能发生作用,因反应用量的不同,会生成不同的磷酸酯,它们均为易溶于水的物质,沸点较低.写出乙醇和磷酸反应生成磷酸二乙酯的化学方程式(磷酸用结构式表示 ![]() ) .
) .
(4)该装置中还缺一种必备仪器,该仪器为 . 某同学认为即使添加了该仪器上述装置验证产生了乙烯不够严密,仍须在酸性高锰酸钾溶液之前添加洗气装置,其理由为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com