
【题目】非金属单质![]() 经如图所示的过程转化为含氧酸
经如图所示的过程转化为含氧酸![]() ,已知
,已知![]() 为强酸,请回答下列问题:
为强酸,请回答下列问题:
![]()
(1)若![]() 在常温下为固体,
在常温下为固体, ![]() 是能使品红溶液褪色的有刺激性气味的无色气体。
是能使品红溶液褪色的有刺激性气味的无色气体。
①![]() 的化学式是__________。
的化学式是__________。
②在工业生产中, ![]() 气体的大量排放被雨水吸收后形成了__________而污染了环境。
气体的大量排放被雨水吸收后形成了__________而污染了环境。
(2)若![]() 在常温下为气体,
在常温下为气体, ![]() 是红棕色的气体。
是红棕色的气体。
①![]() 的化学式是__________。
的化学式是__________。
②![]() 的浓溶液在常温下可与铜反应并生成
的浓溶液在常温下可与铜反应并生成![]() 气体,请写出该反应的化学方程式________________。
气体,请写出该反应的化学方程式________________。
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】(题文)下列有机物说法不正确的是( )
A. BrCH2CHBrCH2Br的名称为三溴丙烷
B. 萘环上的一个H原子被-C4H9取代后的产物共有8种
C. 对甲基苯乙烯中最多有17个原子共面
D. 纤维素和淀粉都是多糖,它们彻底水解后的产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,分别稀释等pH值的盐酸和醋酸,溶液pH随加入水的体积变化的曲线如右图所示。据图判断下列说法正确的是( )

A. Ⅰ为醋酸稀释时pH变化曲线
B. 溶液的导电性:b>a>c
C. 取“0”处等体积的两者溶液分别加足量铁粉,放出H2的量:醋酸>盐酸
D. 取5mL处等体积两者溶液分别与相同的Zn粒反应,开始时的反应速率:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式:
 △H(1)已知:
△H(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)一定条件下,在体积不变的密闭容器中,反应过程中各物质浓度随时间变化的关系如下图所示。在t1时刻加入H2,t2时刻再次达到平衡。物质X为__________,判断理由是_______________________。

(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)。
(4)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用如图表示。[M=n(H2O)/n(乙苯)]

① 比较图中A、B两点对应的平衡常数大小:KA________KB
② 图中投料比(M1、M2、M3)的大小顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某碳酸钠和碳酸氢钠的混合物2.74g加热到质量不再变化时,剩余物质的质量为2.12g。
(1)求混合物中碳酸钠的质量分数?
(2)标准状况下生成CO2气体的体积?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
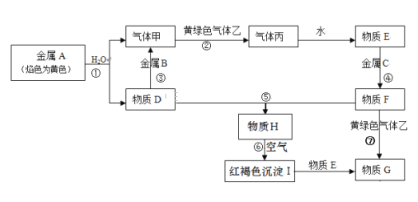
(1)写出下列物质的化学式:B__________,丙__________,乙__________,H__________
(2)根据要求回答:
①D溶液和F溶液在空气中混合的现象__________;
②)反应③离子方程式__________;
③反应⑦离子方程式__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F(![]() )是重要的化工原料,其一种合成路线如下:
)是重要的化工原料,其一种合成路线如下:

已知

(1)写出B的官能团名称___________。
(2)下列有关物质C的说法正确的是________。
a.C的分子式是C9H12O3 b.C的核磁共振氢谱共有4组吸收峰
c.1mlC最多消耗1mol金属Na d.C可以发生取代、加成和消去反应
(3)写出①的化学方程式:____________________________________。
(4)E的结构简式为________________________________________________。
(5) 有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________
有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________
①1mol该物质最多消耗3 mol NaOH; ②苯环上一氯代物只有两种。
(6)参照上述合成路线,设计由乙烯合成2-丁醇的合成路线。(用合成路线流程图表示,并注明反应条件,合过程中只有无机试剂可任选) ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1
NaHCO3溶液的pH由大到小的关系为_____________________________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度由大到小的顺序为___________________________________。
浓度由大到小的顺序为___________________________________。
(3)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2===2HClO+CO![]() b.2HCOOH+CO
b.2HCOOH+CO![]() ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-===2HCOOH+SO![]() d.Cl2+H2O+2CO
d.Cl2+H2O+2CO![]() ===2HCO
===2HCO![]() +Cl-+ClO-
+Cl-+ClO-
(4)某温度(T ℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示.

① 此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_____。
②在此温度下,0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1 mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显________(填“酸”“碱”或“中”)性.写出按乙方式混合后,反应的离子方程式:__________________________。按甲方式混合后,所得溶液的pH为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com