
【题目】某学生用0.1mol/L HCl溶液滴定未知浓度的氢氧化钠溶液,
(1)写出下列仪器名称
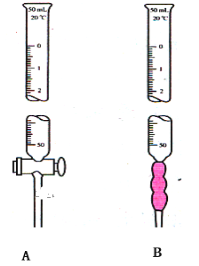
A________________。
B________________。
(2)操作可分解为如下几步:
①检查滴定管是否________________。
②用蒸馏水洗涤滴定管2~3次。
③在加入酸、碱反应液之前,洁净的酸式滴定管和碱式滴定管还要分别用所要盛装的酸、碱溶液________________2~3遍。
④分别将酸、碱反应液加入到酸式滴定管、碱式滴定管中,使液面位于滴定管刻度“0”以上________________处。
⑤装标准溶液和待测溶液并调节液面使滴定管尖嘴充满溶液,准确读取并记录初始_______________。
⑥取一定体积的待测液于锥形瓶中加入指示剂
⑦把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点,记下滴定管液面的刻度.
【答案】酸式滴定管 碱式滴定管 漏水 润洗 2-3cm 读数
【解析】
(1)根据滴定管的结构进行判断;
(2)根据滴定操作流程进行解答。
(1)有玻璃旋塞的为酸式滴定管,有一小段橡胶管的为碱式滴定管;所以A为酸式滴定管;B为碱式滴定管;
综上所述,本题答案是:酸式滴定管;碱式滴定管。
(2)①根据滴定操作可知,滴定管在使用前要检查滴定管是否漏水;②用蒸馏水洗涤滴定管2~3次,③在加入酸、碱反应液之前,洁净的酸式滴定管和碱式滴定管还要分别用所要盛装的酸、碱溶液润洗滴定管2~3遍,以所盛装的溶液被稀释;④分别将酸、碱反应液加入到酸式滴定管、碱式滴定管中,使液面位于滴定管刻度“0”以上2-3cm处;⑤装标准溶液和待测溶液并调节液面使滴定管尖嘴充满溶液,准确读取并记录初始读数;⑥取一定体积的待测液于锥形瓶中加入指示剂;⑦把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点,记下滴定管液面的刻度;
综上所述,本题答案是:漏水;润洗; 2-3cm; 读数。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1的HCl溶液滴定10.00mL 0.1mol/LROH,其滴定曲线如图所示.AG=![]() ,下列分析不正确的是
,下列分析不正确的是

A. ROH为弱碱 B. A点溶液c(Cl)=c(R+)
C. 若b=10时,AG<0 D. 若b=15,溶液中存在c(Cl-)+c(OH-)=c(R+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是
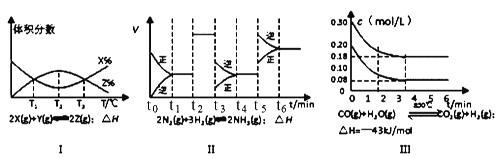
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 由图Ⅱ知,反应在t6时,NH3体积分数最大
C. 由图Ⅱ知,t3时采取的措施是降低反应体系温度
D. Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)![]() CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl _______P2;A、B、C三点处对应平衡常数(KA、KB、KC)的由大到小的顺序为__________。(填“<”、“>”“=”)

②100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则v(H2)=________________100℃时该反应的平衡常数K =_________。反应达到平衡的标志是:_____________。
A.容器内气体密度恒定
B.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C.容器的压强恒定
D.3v正(CH4)= v逆(H2)
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积 C.再充入CH4气体 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数K的说法中,正确的是
A. 在任何条件下,化学平衡常数是一个恒定值
B. 平衡常数K只与温度有关,与反应浓度、压强无关
C. 平衡常数K不仅与温度有关,也与反应浓度、压强有关
D. 对于可逆反应C(s)+H2O(g) ![]() CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式为
CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图:

已知:①CS2不溶于水,比水重;NH3不溶于CS2;②三颈烧瓶内盛放有CS2、水和催化剂。
实验步骤如下:
(1)制备NH4SCN溶液:CS2+3NH3![]() NH4SCN+ NH4HS(该反应比较缓慢)
NH4SCN+ NH4HS(该反应比较缓慢)
①实验前,经检验装置的气密性良好。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是_____。
②实验开始时打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,至CS2消失。
则:装置A中反应的化学方程式是_____;装置C的作用是______。
(2)制备KSCN溶液:熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS= H2S↑ + 3NH3↑),打开K2,再缓缓滴加入适量的KOH溶液,发生反应:NH4SCN + KOH= KSCN + NH3↑ +H2O。
小组讨论后认为:实验中滴加入相同浓度的K2CO3溶液比KOH溶液更好,理由是_____。
(3)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶______,干燥,得到硫氰化钾晶体。
(4)测定晶体中KSCN的含量:称取10.0g样品配成1000mL溶液量取20.00mL于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液做指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN- + Ag+= AgSCN↓(白色)。则判断达到终点时的方法是____。
②晶体中KSCN的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马来酸酐(顺-丁烯二酸酐)![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:①![]()
②
③![]() (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
回答下列问题:
(1)C的名称是________,反应②的反应类型是___________。
(2)B的顺式结构简式为_________,F的结构简式为__________。
(3)反应①的化学方程式为_________。
(4)C有多种同分异构体,其中与C具有完全相同的官能团,且核磁共振氢谱只有两个峰的同分异构体的结构简式为______(不考虑立体异构)。
(5)已知:氨基(-NH2)与羟基类似,也能发生反应①。在由F制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为______。
(6)已知:酸酐在水溶液中极易水解。写出由马来酸酐![]() 合成酒石酸
合成酒石酸![]() 的合成路线:____________________。
的合成路线:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关电化学知识的描述正确的是

A. Cu+H2SO4= CuSO4+H2↑这个反应可设计成原电池。
B. 利用Cu+2FeCl3=CuCl2+2FeCl2,可设计如图所示原电池装置,盐桥内K+向FeCl3溶液移动。
C. 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,铁作负极,铜作正极,其负极反应式为Fe-2e-=Fe2+。
D. 由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-=Mg(OH)2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2![]() PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com