
【题目】下列说法错误的是( )
A.苯环的碳碳键键长都相等
B.苯分子中有C=C,所以能使溴水反应而褪色
C.邻﹣二溴苯没有同分异构体
D.常温下苯是一种不溶于水且密度小于水的液体
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学利用下图来验证某铜银合金完全溶解于浓硝酸对生成的气体除NO2外还含有NO,并测定合金中铜的质量分数。已知常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4晶体。

(1)写出A中铜与硝酸反应的一个化学方程式________________________。
(2)反应前先打开A部分的活塞K,持续通入一段时间的N2,理由是_______________。若装置中缺少B部分,会影响验证的结果,其原因是____________________。
(3)反应结束后,打开活塞K2,并通入O2,若有NO产生,则D产生的现象是_________。
(4)实验测得的数据如下:合金质量15.0g,13.5mol/LHNO340mL;实验后A溶液:V=40 mL,c(H+)=1.0mol/L,假设反应中硝酸无挥发也没有分解。则反应中消耗的HNO3物质的量为____________mol。
(5)利用A装置中反应后溶液也可确定铜的质量分数,方法是取出A中的反应的溶液,向其中加入足量的_____溶液,然后进行的操作的步骤分别是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把原子数和价电子数相同的分子或离子称为等电子体.人们发现等电子体的结构和性质相似.下列有关无机苯(B3N3H6)有关说法中错误的是( )
A.B3N3H6分子各原子均在同一平面上
B.B3N3H6是由极性键组成的均匀而对称的非极性分子
C.B3N3H6能发生加成反应和取代反应
D.B3N3H6的二氯取代物有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C ![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2 ![]() CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2 , NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2 , NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
(1)写出与Ca在同一周期且最外层电子数为1、内层电子全排满的基态原子的核外电子排布式: .
(2)CaCN2中阴离子为CN ![]() ,与CN
,与CN ![]() 互为等电子体的分子有N2O和(填化学式),由此可以推知CN
互为等电子体的分子有N2O和(填化学式),由此可以推知CN ![]() 的空间构型为 .
的空间构型为 .
(3)尿素分子中C原子采取杂化.尿素分子的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:
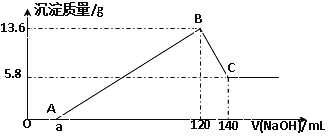
(1)写出OA段和BC段反应的离子方程式:
OA:________________________________ ; BC:_____________________________;
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
(5)a的值是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,负极反应为:PbO2+4HBF4-2e-=Pb(BF4)2+2BF4-+2H2O
B. 充电时,当正极质量减少23.9g时转移0.2mol电子
C. 放电时,PbO2电极附近溶液的pH增大
D. 充电时,Pb电极的电极反应式为PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为CH4燃料电池的装置(A、B为多孔碳棒):
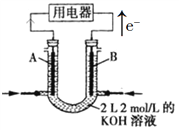
(1)_____(填A或B)处电极入口通甲烷,其电极反应式为_____________。
(2)当消耗甲烷的体积为11.2 L(标准状况下)时,消耗KOH的质量为_______g。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成。该电池工作时,正极的电极反应式为____________________。
(4)500 mL KNO3和Cu(NO3)2的混合溶液中c(![]() )=6.0 mol·L1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL。原混合溶液中c(K+)为_________mol·L1。
)=6.0 mol·L1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL。原混合溶液中c(K+)为_________mol·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁分析中常用高氯酸(HClO4)溶解矿样,某研究性学习小组欲制取少量高氯酸。该学习小组查阅到:
a.HClO4浓度高于60%时遇含碳化合物易爆炸,浓度低于60%时比较稳定;
b.NaClO4与浓硫酸反应可制得高氯酸,若采用真空蒸馏可得纯高氯酸;
c.NaClO3在673K(400℃) 分解产生NaClO4、NaCl和一种气体。
该小组同学设计实验分三步制备高氯酸:
(一)制氯气并使制得的氯气与氢氧化纳溶液反应制氯酸纳;
(二)氯酸钠分解制高氯酸钠;
(三)高氯酸纳与浓硫酸反应制高氯酸[2NaClO4+H2SO4(浓)![]() Na2SO4+2HClO4]。
Na2SO4+2HClO4]。
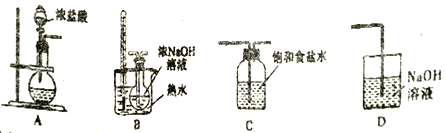
(1)制取氯酸钠的装置连接顺序为A,___________
(2)B 装置中发生反应的离子方程式为__________________________。
(3)为了制备高氯酸钠并推出氯酸钠分解制高氯酸钠的化学方程式,该小组设计了两组装置(甲,乙)如下:
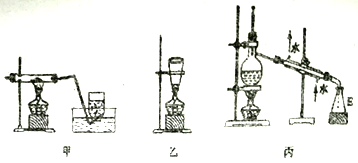
该小组经过分析决定选用甲装置制备高氯酸钠,取NaClO3样品2.13 g,加热充分反应后集气瓶中收集到224 mL (标准状况下)气体,则该反应的化学方程式为_________________________;不选用乙装置的原因可能为______________________。
(4)用丙裝置制备高氯酸,向烧瓶中加入高氯酸钠,然后加入浓硫酸后,加热可制取高氯酸。实验开始前,胶塞及导管接口需要包锡箔纸,其原因是___________,仪器E的名称为___________。该组同学发现操作中少加入一种物质,该物质的名称为___________。发现后的正确操作为_________________。
(5)工业上大量制备NaClO4常用高电流密度电解NaClO3的方法,试写出以惰性电极电解时的阳极反应式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列变化①工业制盐酸 ②工业制漂粉精 ③实验室制氯气中,按氯元素被氧化、被还原、既被氧化又被还原的顺序排列,正确的是( )
A. ①②③ B. ②①③ C. ①③② D. ③①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com