
【题目】在1L 1mol/L的氨水中,下列有关说法正确的是
A.NH3·H2O为1mol ,溶质质量为35g
B.NH4+为1mol ,溶质质量为18g
C.溶解状态的NH3分子为1mol,溶质质量为17g
D.氨水中NH3、NH3·H2O、NH4+三种微粒总的物质的量为1mol
科目:高中化学 来源: 题型:
【题目】已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol O===O键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收能量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产.下列对于反应 2SO2+O2 ![]() 2SO3的说法中正确的是( )
2SO3的说法中正确的是( )
A. 只要选择适宜的条件,SO2和O2就能全部转化为SO3
B. 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
C. 该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
D. 在达到平衡的体系中,充入由18O原子组成的O2后,18O仅存在于SO2和SO3中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O;IO3-→I2;MnO4-→Mn2+;HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2 B.IO3- C.MnO4- D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
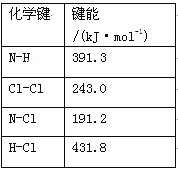
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
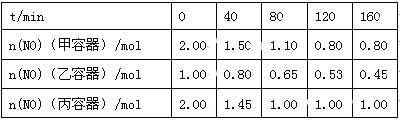
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
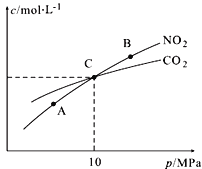
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向100 mL 0.1 molL-1 NH4HSO4溶液中滴加0.1 molL-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸)。下列说法错误的是( )

A. a点时溶液的pH<1
B. a点到b点的过程中,溶液的导电能力减弱
C. ab段上的点(不包括a点)均满足关系式:c(NH4+)+c(Na+)<2c(SO42-)
D. b点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是( )
A.2.24LCO或N2所含的电子数为1.4NA
B.标准状况下,22.4升H2O中所含分子数小于NA
C.常温常压下,33.6L氯气与56 g铁充分反应,转移的电子数为3NA
D.常温常压下,1.8 g H2O含有的质子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,小试管内盛有约3 mL饱和硫酸铜溶液,与锥形瓶连通的U型细管内盛有少量水(为便于观察,预先染成红色),沿小试管的内壁小心地慢慢注入约3 mL浓硫酸,静置片刻,不可能观察到的现象是( )

A. 小试管内液体分成两层,上层蓝色,下层无色
B. U型细管内左边液面下降,右边液面升高
C. 小试管内有少量白色固体析出
D. 小试管内液体不分层,但有蓝色晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H+ + HA-,HA-![]() H++A2-。回答下列问题:
H++A2-。回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系不正确的是_________。
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度________(填“>”、“<”或“=”)0.11mol·L-1。
II.亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3![]() H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+) = 2.5×10-2mol·L-1,除OH-之外其他离子的浓度由大到小的顺序是 ,
②写出亚磷酸与少量NaOH溶液反应的离子方程式 。
III.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(1)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)![]() CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
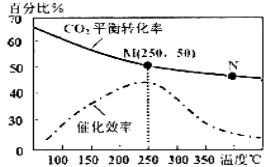
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如右上图,下列有关说法不正确的是_______(填序号)
①温度越高,催化剂的催化效率越高
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随着温度升高,乙烯的产率增大
④增大压强可提高乙烯的体积分数
⑤N点正反应速率一定大于M点正反应速率
IV.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(3)若在500℃时,投料![]() =1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
=1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com