
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),下列说法错误的是 ( )
CuS(s)+Mn2+(aq),下列说法错误的是 ( )
A. 相同条件下,MnS的Ksp比CuS的Ksp大
B. 该反应的平衡常数K=![]()
C. 该反应达到平衡时c(Mn2+)=c(Cu2+)
D. 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
科目:高中化学 来源: 题型:
【题目】将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)![]() P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )

A. 若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B. 温度为T1时,N的平衡转化率为80%,平衡常数K=40
C. 无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D. 降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A. 检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B. 检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
C. 检验试液中的I-:试液![]() 无明显现象
无明显现象![]() 蓝色溶液
蓝色溶液
D. 检验试液中的CO32-:试液![]() 白色沉淀
白色沉淀![]() 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题:
(1)标准状况下,2.24L Cl2的质量为__________g。
(2)10.8g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为__________。
(3)阻燃剂碱式碳酸铝镁中OH-与CO32-质量之比为51:300,则这两种离子的物质的量之比为____________。
(4)将10mL 1.00mol/L Na2CO3溶液与10mL 1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为______________mol/L(忽略混合前后溶液体积的变化)。
(5)3.5mol Ba(OH)2中约含有____________个OH-。
(6)100g质量分数为46%的酒精(CH3CH2OH)溶液中氧原子的物质的量为___________。
(7)把 200mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的盐酸恰好反应完全.该混合溶液中c(Na+)为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲表示叶绿体的结构,图乙表示暗反应过程。请据图回答下列问题:

(l)叶绿体中的色素分布于图甲中的____ (填序号);四种色素能在滤纸条上分离,是因为____。
(2)叶绿体进行光合作用时,ATP的移动方向是从____到____(填序号),合成ATP所需的能量来自____。
(3)在光照强度、温度和CO2浓度三种环境因素中,能直接影响图乙所示过程的是 _________。若突然降低光照强度,则在短时间内叶绿体中C3和C5的含量变化分别是 _________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在一定条件下,可以发生R—CH![]() CH2+HX
CH2+HX![]()
A、B、C、D、E有如下转化关系:
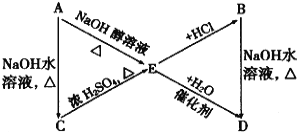
其中A、B分别是化学式为C3H7Cl的两种同分异构体。根据图中各物质的转化关系,填写下列空白:
(1) B的结构简式:_________________________
(2) 完成下列反应的化学方程式:
①A→C__________________________________________________________________;
②E→D__________________________________________________________________;
Ⅱ.从樟科植物枝叶提取的精油中其中含有下列甲、乙两种成分:

(1)乙中含有的官能团的名称为______________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
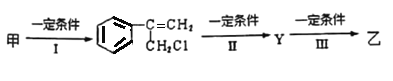
①反应I的反应类型是________________________;反应II的条件是_________________;
②反应III的化学方程式为__________________________________(不需注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(x)。纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃气体,C是A和B的混合气体,则C中n(A)∶n(B)为 ( )

A. 2∶1 B. 1∶2 C. 1∶1 D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取AgNO3基准物4.2468 g(0.0250 mol)后,配制成250 mL溶液,放在棕色试剂瓶中避光保存,回答问题:
(1)配制该溶液所使用的玻璃仪器除烧杯和玻璃棒外还有_____。
(2)AgNO3溶液放在棕色试剂瓶中保存的原因是_________。
(3)下列情况对所配溶液的物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①转移液体后未洗涤烧杯:__________。
②摇匀后发现液面低于刻度线,再加水:______。
③容量瓶中原有少量蒸馏水:_______。
④定容时用俯视观察液面:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
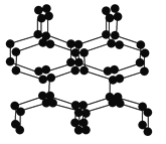
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com