
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=﹣1275.6kJmol-1
②2CO(g)+O2(g)=2CO2(g) △H2=﹣566.0kJmol-1
③H2O(g)=H2O(l) △H3=﹣44.0kJmol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___。
(2)工业上甲醇利用水煤气合成,反应为CO(g)+2H2(g)=CH3OH(g) ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
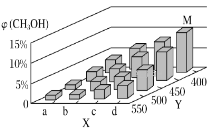
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②X轴上a点的数值比b点___(填“大”或“小”)。
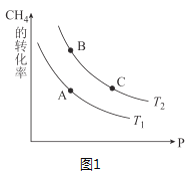
③生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)CO(g)+3H2(g) △H>0,一定条件下CH4的平衡转化率与温度、压强的关系如图1。则T1___T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为____。
(3)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图2所示,其中Y为CO2。
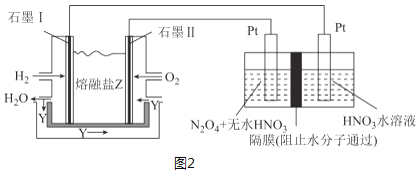
写出石墨Ⅰ电极上发生反应的电极反应式___。在电解池中生成N2O5的电极反应式为___。
【答案】CH3OH(1)+O2(g)=CO(g)+2H2O(1) △H=﹣442.8kJmol-1 25% 小 < KC=KB>KA ![]() N2O4+2HNO3﹣2e-=2N2O5+2H+
N2O4+2HNO3﹣2e-=2N2O5+2H+
【解析】
(1)根据盖斯定律![]() 得目标方程式,求得目标方程式焓变;
得目标方程式,求得目标方程式焓变;
(2)①列三段式计算一氧化碳的转化率,②根据方程式系数及反应焓变判断反应的移动方向和温度压强的关系,进而判断,③平衡常数只与温度有关,根据温度比较平衡常数;
(3)判断阴阳极,正负极根据题目信息写出电极反应式即可。
(1)已知:①![]() ②
②![]() ③
③![]() ,根据盖斯定律,
,根据盖斯定律,![]() 可得:
可得:![]() ,
,
故答案为:![]() ;
;
(2)①设平衡时生成甲醇xmol,列三段式: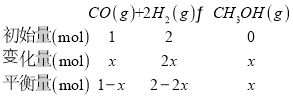 ,根据M点
,根据M点![]() 的体积分数为10%,即
的体积分数为10%,即![]() ,解得x=0.25,故
,解得x=0.25,故![]() 的转化率为
的转化率为![]() ,
,
故答案为:25%;
②![]() ,升温该反应逆向移动,即温度越高甲醇体积分数小,加压该反应正向移动,即压强越大甲醇体积分数越大,由图像可知Y轴代表温度,X轴代表压强,且abcd依次增大,
,升温该反应逆向移动,即温度越高甲醇体积分数小,加压该反应正向移动,即压强越大甲醇体积分数越大,由图像可知Y轴代表温度,X轴代表压强,且abcd依次增大,
故答案为:小;
③该反应为吸热反应,温度越高甲烷转化率越大,故T1<T2;对于吸热反应,温度越高平衡常数越大,且相同温度下平衡常数相同,故KC=KB>KA,
故答案为:<;KC=KB>KA;
(3)石墨Ⅰ电极通入氢气,发生氧化反应生成水,电极反应式为:![]() ;电解池
;电解池![]() 发生氧化反应生成
发生氧化反应生成![]() ,电极反应式为:
,电极反应式为:![]() ,
,
故答案为:![]() ;
;![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是

A. 每生成1 mol NCl3,理论上有4 mol H+经质子交换膜右侧向左侧迁移
B. 可用湿润的淀粉KI试纸检验气体M
C. 石墨极的电极反应式为NH4++3Cl--6e-= NCl3 +4H+
D. 电解过程中,质子交换膜右侧溶液的pH会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出_______的改变对反应速率的影响,其中V1=_____,T1=span>_____,通过实验_______可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是______________________;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为__________。
(3)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式_______________。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________,相应的粒子最有可能是(填符号)_______。
Ⅱ.(1)用大苏打(硫代硫酸钠)和硫酸溶液发生反应时溶液变浑浊的时间,也可研究外界条件对化学反应速率的影响。写出相应反应的化学方程式_______。
(2)已知大苏打溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. NaHCO3溶液的物质的量浓度为0.8 mol/L
B. b点与c点溶液所含微粒种类相同
C. a点溶液中存在的离子是Na+、AlO2-、OH-、H+
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O === Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是![]() 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式:____________
(2)对反应N2O4(g)![]() 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____

A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为____________
②n3_____n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________,升高温度后,反应2NO2![]() N2O4的衡常数K将______(填“增大”、“减小”或“不变”)。
N2O4的衡常数K将______(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于反应mA(g)+n(B)![]() cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,
cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,
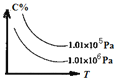
下列该反应的![]() 、
、![]() 判断正确的是
判断正确的是
A.![]() >0,
>0,![]() <0B.
<0B.![]() <0,
<0,![]() >0
>0
C.![]() >0,
>0,![]() >0D.
>0D.![]() <0,
<0,![]() <0
<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.可以用灼烧后闻气味区别棉花和羊毛
B.油脂水解一定全部生成甘油和高级脂肪酸
C.向蛋白质溶液中加入重金属盐溶液可使蛋白质产生盐析
D.淀粉和纤维素的组成都是![]() ,但淀粉水解纤维素不能水解
,但淀粉水解纤维素不能水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种烃分子的结构如图所示,下列有关说法错误的是( )
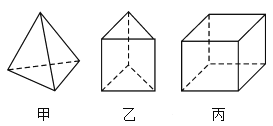
A.1 mol甲分子内含有10 mol共价键
B.由乙分子构成的物质不能发生氧化反应
C.丙分子的二氯取代产物只有三种
D.三者不互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题:
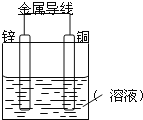
Ⅰ.若电解质溶液为稀硫酸,
(1)Zn棒为原电池的___极,其电极反应式为:___。
(2)Cu棒为原电池的___极,其电极反应式为:___。
Ⅱ.以KOH溶液为电解质溶液,写出甲烷燃料电池的电极反应式
负极反应式:___。
正极反应式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com