
����Ŀ������ij�о���ѧϰ������H2C2O4��Һ������KMnO4��Һ֮��ķ�Ӧ��̽������������ı�Ի�ѧ��Ӧ���ʵ�Ӱ������ʵ�����£�
ʵ����� | ʵ���¶� | KMnO4��Һ | H2C2O4��Һ | H2O | ��Һ��ɫʱ�� | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
��1��ͨ��ʵ��A��B����̽����_______�ĸı�Է�Ӧ���ʵ�Ӱ�죬����V1=_____��T1=span>_____��ͨ��ʵ��_______��̽�����¶ȱ仯�Ի�ѧ��Ӧ���ʵ�Ӱ�졣
��2����t1��8������ʵ��A��B���Եó��Ľ�����______________________������ʵ��B�����ݼ��㣬�ӷ�Ӧ��ʼ���н�������KMnO4��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ__________��
��3���÷�Ӧ������ɫ��ζ������������̱���ԭΪMn2+��д����Ӧ��Ӧ�����ӷ���ʽ_______________��
��4����С���һλͬѧͨ���������Ϸ��֣���Ӧһ��ʱ���÷�Ӧ���ʻ�ӿ죬��ɴ��ֱ仯��ԭ���Ƿ�Ӧ��ϵ�е�ij�����Ӷ�KMnO4��H2C2O4֮��ķ�Ӧ��ij����������ã����������_______________����Ӧ���������п����ǣ�����ţ�_______��
������1���ô��մ���������ƣ���������Һ������Ӧʱ��Һ����ǵ�ʱ�䣬Ҳ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�졣д����Ӧ��Ӧ�Ļ�ѧ����ʽ_______��
��2����֪���մ���Һ��Cl2��Ӧʱ��1mol Na2S2O3ת��8mol���ӡ��÷�Ӧ�����ӷ���ʽ��__________��
���𰸡�Ũ�� 1 293K BC ����������ͬʱ������Ӧ��Ũ�ȷ�Ӧ�������� 8.3��10��4mol/��L��s�� 2MnO42����5H2C2O4��6H��=2Mn2����10CO2����8H2O ������ Mn2�� Na2S2O3+H2SO4=Na2SO4+S��+SO2��+H2O S2O32- + 4Cl2 + 5H2O = 2SO42- + 8Cl- + 10H+
��������
��(1)A��BӦ�����¶���ͬ��̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬B��C�¶Ȳ�ͬ��̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻
(2)��t1��8����Ũ��Խ��Ӧ����Խ���v=![]() ���㣻
���㣻
(3)����2KMnO4+5H2C2O4+3H2SO4�TK2SO4+2MnSO4+10CO2��+8H2O�����ᡢ������̼��ˮ�����ӷ�Ӧ�б�����ѧʽ��
(4)��Ӧ���ɵ������ӿ��������ӿ췴Ӧ���ʣ�
��(1)���մ�(���������)��������Һ������Ӧʱ��Һ����ǣ�˵����Ӧ����S���ɣ���ϵ����غ��ж���������ΪSO2��
(2)������ǿ�����ԣ��ܽ�S2O32-����Ϊ2SO42-��
��(1)ʵ��A��B���μ�H2C2O4��Һ��������ȣ���ʵ��A��B����̽����Ũ�ȵĸı�Է�Ӧ���ʵ�Ӱ�죻��ʵ��A��֪����֤��Һ�������Ϊ6mL��B��H2C2O4��Һ3ml�������ˮ6mL-2mL-3mL=1mL��A��B�¶���ͬ���о�Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��T1=293K��B��C�¶Ȳ�ͬ������������ͬ����ͨ��B��Cʵ���̽�����¶ȱ仯�Ի�ѧ��Ӧ���ʵ�Ӱ�죻
(2)��t1��8�����ɴ�ʵ����Եó��Ľ���������������ͬʱ������Ӧ��Ũ�ȣ���Ӧ��������������ʵ���Ϊ0.10molL-1��0.003L=0.0003mol��������ص����ʵ���Ϊ0.02molL-1��0.002L=0.00004mol�����������ص����ʵ���֮��Ϊ0.0003mol��0.00004mol=3��4����Ȼ������������������ȫ��Ӧ����Ϻ���Һ�и�����ص�Ũ��Ϊ![]() =0.0067mol/L����KMnO4��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ
=0.0067mol/L����KMnO4��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ![]() =8.3��10��4mol/(L��s)��
=8.3��10��4mol/(L��s)��
(3)��������Ը��������Һ����������ԭ��Ӧ���ɶ�����̼�������Ӻ�ˮ�����ӷ�Ӧ����ʽΪ5H2C2O4+2MnO4-+6H+=2Mn2++10CO2��+8H2O��
(4)��Ӧһ��ʱ���÷�Ӧ���ʻ�ӿ죬��ɴ��ֱ仯��ԭ���Ƿ�Ӧ��ϵ�е�ij�����Ӷ�KMnO4��H2C2O4֮��ķ�Ӧ��ij����������ã���������Ǵ����ã���Ӧ���������п�����Mn2+��
��(1)���մ�(���������)��������Һ������Ӧʱ��Һ����ǣ�˵����Ӧ����S���ɣ���ϵ����غ��ж���������ΪSO2��������Ӧ�Ļ�ѧ����ʽΪNa2S2O3+H2SO4=Na2SO4+S��+SO2��+H2O��
(2)������ǿ�����ԣ��ܽ�S2O32-����Ϊ2SO42-���ʷ�Ӧ�����ӷ���ʽ�ǣ�S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��Ӧ:2E(g)+F(g)![]() 2G(g)��ͼ�������Ǹ÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�����ߣ�y���ʾF��ת���ʣ�ͼ����a��b��c���㣬��������������ȷ����
2G(g)��ͼ�������Ǹ÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�����ߣ�y���ʾF��ת���ʣ�ͼ����a��b��c���㣬��������������ȷ����

A. �÷�Ӧ�Ƿ��ȷ�Ӧ
B. b��ʱ��������ƽ��Ħ���������ٱ仯
C. T1�¶���a���ʾ����ﵽƽ�⣬���Բ�ȡ����ѹǿ�ķ���
D. c ��ɱ�V����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V 1 mL 0.1mol��L-1��Fe2(SO4)3��Һ��2mL 0.1mol��L-1KI��Һ��ϣ�����ַ�Ӧ�����з�����֤���÷�Ӧ����һ���ȵ��ǣ� ��
A.��V1<1���������B.��V1��1������KSCN��Һ
C.��V1��1������AgNO3��ҺD.����Ba(NO3)2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���![]() ��ij��Ԫ����
��ij��Ԫ����![]() ��Һ����μ���NaOH��Һ��
��Һ����μ���NaOH��Һ��![]() A��
A��![]() ��
��![]() �����ʵ���������pH�ı仯��ͼ��ʾ������������ȷ����
�����ʵ���������pH�ı仯��ͼ��ʾ������������ȷ����

A.�������ʵ�����NaHA��![]() ���������ˮ��������Һ��
���������ˮ��������Һ��![]()
B.![]() ʱ����Һ����Ũ�ȵĴ�С��ϵΪ��
ʱ����Һ����Ũ�ȵĴ�С��ϵΪ��![]()
C.M��ʱ��![]()
![]()
D.��֪KHA������ˮ������![]() ����
����![]() ����ҺpH��
����ҺpH��![]() ֮��Ϊ���
֮��Ϊ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ�����й�����Һ��pH���������ʵ���Ũ�ȵ�˵������ȷ���ǣ� ��
A.pH=3�Ķ�Ԫ����H2R��Һ��pH=11��NaOH��Һ��Ϻ��Һ��pH����7����Ӧ��Ļ��Һ�У�2c(R2-)+c(HR-)=c(Na+)
B.ij��Һ��ֻ����Cl-��OH-��NH4+��H+�������ӣ���һ�����������й�ϵ��c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C.ij���ʵ���Һ����ˮ�������c(H+)=1��10-amolL-1����a>7������Һ��pHһ��Ϊ14-a
D.��0.2molL-1��ijһԪ��HA��Һ��0.1molL-1NaOH��Һ�������Ϻ���ҺpH����7����Ӧ��Ļ��Һ�У�2c(OH-)+c(A-)=2c(H+)+c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ȼ�ѧ��Ӧ����������ȷ����
A. HCl��NaOH��Ӧ���к��ȡ�H����57.3 kJ��mol1����H2SO4��Ca(OH)2��Ӧ���к��ȡ�H=2��(��57.3)kJ��mol1
B. ����ı�ȼ���Ȧ�H����890.3 kJ��mol1����CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H����890.3 kJ��mol1
C. ��֪��500�桢30MPa�£�N2(g)��3H2(g)![]() 2NH3(g) ��H����92.4kJ��mol��1����1.5 mol H2������N2�ڴ������³�ַ�Ӧ���ų�����46.2 kJ
2NH3(g) ��H����92.4kJ��mol��1����1.5 mol H2������N2�ڴ������³�ַ�Ӧ���ų�����46.2 kJ
D. CO(g)��ȼ������283.0kJ��mol1����2CO2(g) ===2CO(g)+O2(g)��Ӧ�ġ�H��+566.0 kJ��mol1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��� 0. 100 mol L-1 ������ζ� 0.1 00 molL-1 �İ�ˮ����ζ�������ͼ��ʾ��
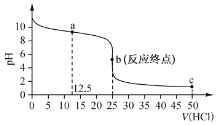
����˵����ȷ����
A. �õζ��������ü�����ָʾ��
B. a ����Һ�У�c(NH4+)>c(NH3 H2O)>c(Cl- )
C. c ����Һ�У�c(Cl-)>c(NH4+)>c(H+)
D. a��c��������ƿ��ˮ�ĵ���Ȳ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʹ�������Դ��չ����̼���á�������Ϊ��ѧ���о�����Ҫ���⡣�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1����֪����2CH3OH��l��+3O2��g����2CO2��g��+4H2O��g�� ��H1����1275.6kJmol-1
��2CO��g��+O2��g����2CO2��g�� ��H2����566.0kJmol-1
��H2O��g����H2O��l�� ��H3����44.0kJmol-1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��___��
��2����ҵ�ϼ״�����ˮú���ϳɣ���ӦΪCO(g)��2H2(g)=CH3OH(g) ��H<0����һ�������£���1molCO��2molH2ͨ���ܱ������н��з�Ӧ�����ı�ijһ�������(�¶Ȼ�ѹǿ)ʱ��CH3OH�����������(CH3OH)�仯������ͼ��ʾ��
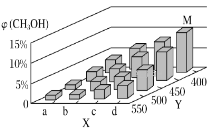
��ƽ��ʱ��M��CH3OH���������Ϊ10%����CO��ת����Ϊ___��
��X����a�����ֵ��b��___(���С��)��
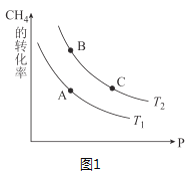
�������״���ԭ��CO��H2��Դ�ڣ�CH4��g��+H2O��g��CO��g��+3H2��g�� ��H��0��һ��������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1����T1___T2���������������������������ͬ����A��B��C���㴦��Ӧƽ�ⳣ����KA��KB��KC���Ĵ�С��ϵΪ____��
��3������H2��O2��������Na2CO3��ɵ�ȼ�ϵ�أ����õ�ⷨ�Ʊ�N2O5��װ����ͼ2��ʾ������YΪCO2��
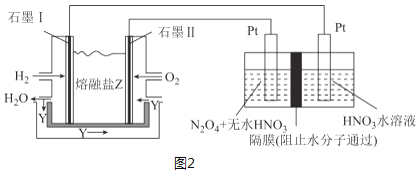
д��ʯī��缫�Ϸ�����Ӧ�ĵ缫��Ӧʽ___���ڵ���������N2O5�ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100mL���͵�H2S��Һ��ͨ��SO2����(�����������ɱ�״��)��������Ӧ��2H2S+SO2=3S��+2H2O�������ҺpH��ͨ��SO2�Ĺ�ϵ��ͼ��ʾ�������й�˵��������ǣ� ��
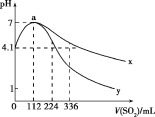
A.a��ˮ�ĵ���̶����
B.���¶���H2S��Ka1��10-7.2
C.����y��������ͨ��SO2�������ҺpH�ı仯
D.a��֮����SO2�����ͨ�룬![]() ��ֵʼ�ռ�С
��ֵʼ�ռ�С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com