
【题目】常温时,下列关于溶液的pH或微粒的物质的量浓度的说法不正确的是( )
A.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+)
B.某溶液中只存在Cl-、OH-、NH4+、H+四种离子,则一定不存在下列关系:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C.某物质的溶液中由水电离出的c(H+)=1×10-amolL-1,若a>7,则溶液的pH一定为14-a
D.将0.2molL-1的某一元酸HA溶液和0.1molL-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA)
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH>0
4NO2(g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
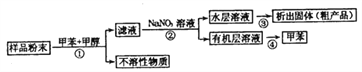
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义![]() ,
,![]() 。常温下,某浓度
。常温下,某浓度![]() 溶液在不同pH值下,测得
溶液在不同pH值下,测得![]() 、
、![]() 、
、![]() 变化如图所示。下列说法正确的是
变化如图所示。下列说法正确的是
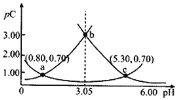
A.![]() 时,
时,![]()
B.常温下,![]() ,
,![]()
C.b点时,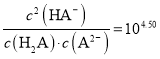
D.![]() 时,
时,![]() 先增大后减小
先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1所示),用环己醇制备环己烯。

已知:![]()
![]()
![]() +H2O
+H2O

(1)制备粗品:
将12.5mL环己醇与1mL浓硫酸加入试管A中,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①在试管中混合环已醇和浓硫酸操作时,加入药品的先后顺序为___。
②如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是(_____)
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
③将试管C置于冰水中的目的是___。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。向粗品中加入饱和食盐水,振荡、静置、分层,环己烯在___层(填“上”或“下”),分液后用___(填字母)洗涤。
A.酸性KMnO4溶液 B.稀硫酸 C.Na2CO3溶液
②再将提纯后的环己烯按如图2所示装置进行蒸馏。图中仪器a的名称是___。实验中冷却水从___(填字母)口进入。蒸馏时要加入生石灰,目的是___。若在制备粗品时环已醇随产品一起蒸出,则实验制得的环己烯精品质量___(填“高于”、“低于”)理论产量。本实验所得到的环已烯质量为6.25g,则产率是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出_______的改变对反应速率的影响,其中V1=_____,T1=span>_____,通过实验_______可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是______________________;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为__________。
(3)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式_______________。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________,相应的粒子最有可能是(填符号)_______。
Ⅱ.(1)用大苏打(硫代硫酸钠)和硫酸溶液发生反应时溶液变浑浊的时间,也可研究外界条件对化学反应速率的影响。写出相应反应的化学方程式_______。
(2)已知大苏打溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol CH4含有的电子数为NA
B.标准状况下,2.24 L CCl4中含有的氯原子数为0.4 NA
C.1 mol丙烯醛分子中含有的双键数为NA
D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是![]() 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式:____________
(2)对反应N2O4(g)![]() 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____

A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为____________
②n3_____n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________,升高温度后,反应2NO2![]() N2O4的衡常数K将______(填“增大”、“减小”或“不变”)。
N2O4的衡常数K将______(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图所示:
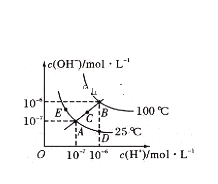
据图回答下列问题:
①图中A、B、C三点处![]() 的大小关系为____________________________________。
的大小关系为____________________________________。
②在A点处,温度不变时,往水中通入适量HCl气体,可以使体系从A点变化到________点。
③在B点处,0.01mol/L的NaOH溶液的pH=_______________。
④在B点处,0.5mol/L ![]() 溶液与1mol/L的KOH溶液等体积混合,充分反应后,所得溶液的pH=__________。
溶液与1mol/L的KOH溶液等体积混合,充分反应后,所得溶液的pH=__________。
⑤在A点处,1g水中含有H+的个数为___________,水的电离平衡常数K与水的离子积![]() 关系为________________。
关系为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com