
【题目】常温下,向![]() 的某二元弱酸
的某二元弱酸![]() 溶液中逐滴加入NaOH溶液,
溶液中逐滴加入NaOH溶液,![]() A、
A、![]() 、
、![]() 的物质的量分数随pH的变化如图所示。下列叙述正确的是
的物质的量分数随pH的变化如图所示。下列叙述正确的是

A.将等物质的量的NaHA和![]() 混合物溶于水,所得溶液中
混合物溶于水,所得溶液中![]()
B.![]() 时,溶液中微粒浓度的大小关系为:
时,溶液中微粒浓度的大小关系为:![]()
C.M点时,![]()
![]()
D.已知KHA难溶于水,若用![]() 沉淀
沉淀![]() ,溶液pH在
,溶液pH在![]() 之间为最佳
之间为最佳
【答案】D
【解析】
由图可知,pH=1.0时,几乎全为H2A,随pH的增大,H2A逐渐减少,HA-逐渐增加,pH=3.04时,c(H2A)= c(HA-),![]() =c(H+)=10-3.04;pH=4时,c(HA-)达到最大;c(A2-)也逐渐增加,pH接近4时,c(H2A)= c(A2-); pH=4.87时,c(HA-)= c(A2-),
=c(H+)=10-3.04;pH=4时,c(HA-)达到最大;c(A2-)也逐渐增加,pH接近4时,c(H2A)= c(A2-); pH=4.87时,c(HA-)= c(A2-),![]() =c(H+)=10-4.87;Ka1
=c(H+)=10-4.87;Ka1![]() 2=10-3.04×10-4.87=10-7.91>10-14,所以HA-电离>水解,NaHR溶液显酸性。根据以上认识,结合其它电解质溶液知识可解答各小题。
2=10-3.04×10-4.87=10-7.91>10-14,所以HA-电离>水解,NaHR溶液显酸性。根据以上认识,结合其它电解质溶液知识可解答各小题。
![]() 将等物质的量的NaHA和
将等物质的量的NaHA和![]() 混合物溶于水:根据分析,Ka2=10-4.87>10-7,所以HA-的电离> A2-的水解,溶液中存在c(HA-)< c(A2-),故A错误;
混合物溶于水:根据分析,Ka2=10-4.87>10-7,所以HA-的电离> A2-的水解,溶液中存在c(HA-)< c(A2-),故A错误;
B. 根据图知,![]() 时,
时,![]() ,溶液中溶质主要为NaHA、
,溶液中溶质主要为NaHA、![]() 为二元弱酸,电离程度较小,所以溶液中存在
为二元弱酸,电离程度较小,所以溶液中存在![]() ,故B错误;
,故B错误;
C. M点溶液中溶液体积增大导致其浓度降低,所以M点溶液中存在![]()
![]() ,故C错误;
,故C错误;
D. KHA难溶于水,若用![]() 沉淀
沉淀![]() ,根据图知,要使
,根据图知,要使![]() 最大而
最大而![]() 、
、![]() 浓度较小,所以溶液pH在
浓度较小,所以溶液pH在![]() 之间为最佳,故D正确;
之间为最佳,故D正确;
答案选D。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )
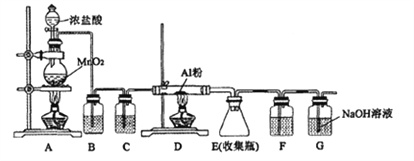
A. B装置中所装试剂为饱和的NaCl溶液,其作用是除去氯气中的HCl
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是

A. 每生成1 mol NCl3,理论上有4 mol H+经质子交换膜右侧向左侧迁移
B. 可用湿润的淀粉KI试纸检验气体M
C. 石墨极的电极反应式为NH4++3Cl--6e-= NCl3 +4H+
D. 电解过程中,质子交换膜右侧溶液的pH会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)![]() I3- (aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),不正确的是( )
I3- (aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),不正确的是( )

A.该反应的正反应是吸热反应B.在反应进行到D点时,v正>v逆
C.A点与C点的化学反应速率vA<vCD.A点与B点相比,B点的c(I2)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义![]() ,
,![]() 。常温下,某浓度
。常温下,某浓度![]() 溶液在不同pH值下,测得
溶液在不同pH值下,测得![]() 、
、![]() 、
、![]() 变化如图所示。下列说法正确的是
变化如图所示。下列说法正确的是
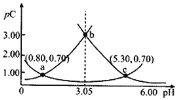
A.![]() 时,
时,![]()
B.常温下,![]() ,
,![]()
C.b点时,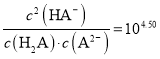
D.![]() 时,
时,![]() 先增大后减小
先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是( )

A.正极的电极反应式为2H++2e-═H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作一段时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出_______的改变对反应速率的影响,其中V1=_____,T1=span>_____,通过实验_______可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是______________________;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为__________。
(3)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式_______________。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________,相应的粒子最有可能是(填符号)_______。
Ⅱ.(1)用大苏打(硫代硫酸钠)和硫酸溶液发生反应时溶液变浑浊的时间,也可研究外界条件对化学反应速率的影响。写出相应反应的化学方程式_______。
(2)已知大苏打溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. NaHCO3溶液的物质的量浓度为0.8 mol/L
B. b点与c点溶液所含微粒种类相同
C. a点溶液中存在的离子是Na+、AlO2-、OH-、H+
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O === Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种烃分子的结构如图所示,下列有关说法错误的是( )
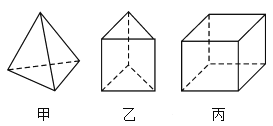
A.1 mol甲分子内含有10 mol共价键
B.由乙分子构成的物质不能发生氧化反应
C.丙分子的二氯取代产物只有三种
D.三者不互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com