
【题目】下列电离方程式正确的是
A.HCl=H+1+Cl-1B.BaCl2=Ba2++Cl2-
C.Na2CO3=2Na++C4++3O2-D.Ba(OH)2=Ba2++2OH-
科目:高中化学 来源: 题型:
【题目】下列各组物质中,都是强电解质的是( )
A.HNO3、HCl、BaSO4B.NH4Cl、CH3COOH、Na2S
C.NaOH、Ca(OH)2、NH3·H2OD.HClO、CH3COONa、Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢钠广泛地应用于生产、实验和日常生活中。某课外小组同学通过查阅资料对碳酸氢钠的性质和制法进行了系列实验,请你参与探究。
(1)向NaHCO3溶液滴加MnCl2溶液生成沉淀MnCO3,离子方程式为______。
(2)向NaHCO3溶液加入少量的镁粉,观察到有气体和白色沉淀生成,则该气体一定是______(填化学式),白色沉淀可能是:①MgCO3;②Mg(OH)2;③Mg2(OH)2CO3。欲证明白色沉淀为②,简单的实验方法为______(操作、现象和结论)。
(3)电解Na2CO3溶液制NaHCO3的原理如图—1所示.
①电解初期,电解池中总反应方程式为______。
②若电解过程中透过交换膜的Na+为 0.4 mol,则阳极收集到 O2_____L(标况)。
③电解后期溶液中的含碳微粒逐渐减少,此阶段阳极反应式为______。
(4) “侯氏制碱法”的原理是: NaCl+NH3+ CO2+H2O= NaHCO3+NH4Cl,模拟该制法的部分装置如图—2所示.
① 正确的操作是______(填序号)。
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b通入NH3,然后a通入CO2,c中放碱石灰
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
② 水槽中的冷水起降温作用,这样有利于______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-36号A、B、C、D、E、F六种元素,其中A、B、C、D、E的原子序数均小于18且其核电荷数依次递增,B元素基态原子电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,D原子的价电子排布为ns2np2n+2,E原子第一至第四电离能(kJ·mol-1)分别为:738、1451、7733、10540。F2+离子K、L、M层全充满。根据以上信息,同答下列问题:
(1)BA4D和BA2D,沸点较高的是________(填相关物质的结构简式)
(2)已知B与A形成的化合物在标准状况下的密度为1.16g·L-1,则在该化合物分子空间构型_________,在该化合物分子中含有σ键和π键个数比__________。
(3)写出单质F与足量C的最高价氧化物对应的水化物稀溶液反应,C被还原到最低价,该反应的化学方程式________________________
(4)B的单质是一种层状结构,元素B和E的形成一种合金,E的原子位于B的层间,其投影位于层面六圆环的中央,“△”表示E的原子位置,平行四边形表示在此二维图形上画出的一个晶胞,该合金的化学式为_______________________。
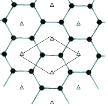
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的是

A. 相同条件下,K(s)的(ΔH2′+ΔH3′)<Na(s)的(ΔH2+ΔH3)
B. ΔH4的值数值上和Cl-Cl共价键的键能相等
C. ΔH5<0,在相同条件下,2Br(g)的ΔH5′>ΔH5
D. ΔH7<0,且该过程形成了分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气脱硫能有效减少二氧化硫的排放,实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6﹣2x]溶液,并用于烟气脱硫研究。

下列说法错误的是
A. 滤渣Ⅰ的主要成分为SiO2
B. 加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6﹣2x
C. 调节pH时若溶液的pH偏高,将会导致溶液中铝元素的含量降低,相应的离子方程式如下:3CaCO3+2Al3++3H2O=2Al(OH)3+3Ca2++3CO2↑
D. 上述流程中经完全热分解放出的SO2量总是小于吸收的SO2的量,其主要原因是溶液中的部分SO32-被氧化成SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH4+、SO42-、CO32-、K+ B. Na+、Ba2+、Ca2+、HCO3-
C. Mg2+、SO42-、K+、Cl- D. K+、Cl-、Na+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学式为![]() 的配合物的说法中正确的是
的配合物的说法中正确的是![]()
![]()
A. 配体是![]() 和
和![]() ,配位数是9
,配位数是9
B. 中心离子是![]() ,配离子是
,配离子是![]()
C. 内界和外界中的![]() 的数目比是2:1
的数目比是2:1
D. 加入足量![]() 溶液,所有
溶液,所有![]() 均被完全沉淀
均被完全沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com