
【题目】1-36号A、B、C、D、E、F六种元素,其中A、B、C、D、E的原子序数均小于18且其核电荷数依次递增,B元素基态原子电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,D原子的价电子排布为ns2np2n+2,E原子第一至第四电离能(kJ·mol-1)分别为:738、1451、7733、10540。F2+离子K、L、M层全充满。根据以上信息,同答下列问题:
(1)BA4D和BA2D,沸点较高的是________(填相关物质的结构简式)
(2)已知B与A形成的化合物在标准状况下的密度为1.16g·L-1,则在该化合物分子空间构型_________,在该化合物分子中含有σ键和π键个数比__________。
(3)写出单质F与足量C的最高价氧化物对应的水化物稀溶液反应,C被还原到最低价,该反应的化学方程式________________________
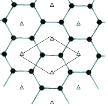
(4)B的单质是一种层状结构,元素B和E的形成一种合金,E的原子位于B的层间,其投影位于层面六圆环的中央,“△”表示E的原子位置,平行四边形表示在此二维图形上画出的一个晶胞,该合金的化学式为_______________________。
【答案】 CH3OH 直线 3:2 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O MgC2
【解析】A、B、C、D、E的原子序数均小于18且其核电荷数依次递增,B元素基态原子电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B为碳元素,D原子的价电子排布为ns2np2n+2,则D为氧元素,则C为氮元素,E原子第一至第四电离能(kJ·mol-1)分别为:738、1451、7733、10540,说明E最外层有2个电子,原子序数大于氧小于18,则E为镁元素,F2+离子K、L、M层全充满,则F为30号元素,锌元素,(2)中B(碳)与A形成的化合物在标准状况下的密度为1.16g·L-1,则该化合物的相对分子质量为26,所以该化合物为C2H2,则A为氢元素,据此答题。
根据以上分析结果,
(1) BA4D和BA2D分别为CH3OH和HCHO,因为CH3OH分子之间可以形成氢键,所以CH3OH沸点较HCHO高,
因此,本题正确答案是:CH3OH;
(2)由C、H元素形成的化合物在标准状况下的密度为1.16g·L-1,则该化合物的相对分子质量为26,所以该化合物为C2H2,分子空间构型为直线型,在C2H2中含有3个σ键和2个π键,所以σ键和π键个数比为3:2,因此,本题正确答案是:直线; 3:2;
(3)锌与稀硝酸溶液反应,氮被还原到最低价,生成硝酸铵,该反应的化学方程式为4Zn+10HNO3(稀)=4Zn(NO3)2+NH4NO3+3H2O ,
因此,本题正确答案是:4Zn+10HNO3(稀)=4Zn(NO3)2+NH4NO3+3H2O ;
(4)以图中一个六边形为例,该六边形中实际占有的碳原子数为6![]() =2,含有的镁原子数为1,该合金的化学式为MgC2,
=2,含有的镁原子数为1,该合金的化学式为MgC2,
因此,本题正确答案是: MgC2。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】下列药品保存方法,正确的是 ( )
A. 乙醇密封保存,放置于阴凉处
B. 氢氧化钠溶液用橡胶塞密封保存在细口瓶中
C. 浓硫酸保存在广口瓶中,没有挥发性,无须密封
D. 金属钠和钾等很活泼的金属可以保存在煤油或石蜡中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某稻壳灰的成分为
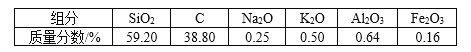
通过如下流程可由稻壳灰制备较纯净的二氧化硅。

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中属于两性氧化物的是________。
(2)步骤①中涉及SiO2的离子反应方程式为______________。
(3)滤渣A的成分有________和_________(填化学式)。
(4)滤渣B的成分是________(填化学式)。
(5)过滤所需的玻璃仪器除烧杯和玻璃棒外,还有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑧元素回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ④ | ⑤ | ⑥ | |||||
三 | ① | ② | ③ | ⑦ | ⑧ |
(1)在这些元素原子中,失电子能力最强的是____(填元素符号),非金属性最强的元素是___(填元素符号)。
(2)单质化学性质最不活泼的元素是______(填元素符号),其原子结构示意图为_____。
(3)元素的最高价氧化物对应的水化物中,呈两性的是_______(填化学式)。
(4)⑤、⑥所代表的元素分别与氢元素形成的氢化物中,热稳定性较强的是_________(填化学式)。
(5)在②、⑥、⑦三种元素中原子半径按从大到小的是_______(填元素符号)表中元素最高价氧化物对应的水化物中,酸性最强的是_________(填化学式)。
(6)写出元素③的单质与稀盐酸反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化的主要原理为:2NO+2CO![]() N2+2CO2 ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。能判断该反应达到平衡状态的标志是
N2+2CO2 ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。能判断该反应达到平衡状态的标志是
A. 在单位时间内生成1mol CO2的同时消耗了lmol CO
B. 混合气体的密度不再改变
C. 混合气体的平均相对分子质量不再改变
D. 相同时间内,形成CO2分子内键的数目是断开N2分子内键的数目的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g),0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是( )
H2(g)+I2(g),0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是( )
A. 容器中,反应平衡时的压强大于起始时的压强
B. c(HI)由0.07mol/L降到0.05mol/L所需的反应时间大于10s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.002mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A.HCl=H+1+Cl-1B.BaCl2=Ba2++Cl2-
C.Na2CO3=2Na++C4++3O2-D.Ba(OH)2=Ba2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应Zn+H2SO4===ZnSO4+H2↑,下列叙述不正确的是
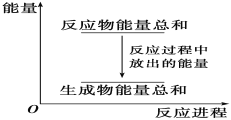
A. 反应过程中能量关系可用上图表示
B. 若将该反应设计成原电池,锌为负极,碳为正极,稀硫酸溶液做电解质
C. 若设计为原电池,当有32.5 g锌溶解,负极放出11.2 L气体(标准状况下)
D. 若设计为原电池,负极有电流流入
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com