
【题目】碳及其化合物广泛存在于自然界中,试回答下列问题:
(1)某处碳循环如图所示,CaCO3转化为HCO3-的离子方程式为_____________。

(2)常温常压下,空气中的CO2溶于水,达到平衡时,无机碳在浓液中以4种形式存在,其转化关系如下:
①CO2(g)+H2O![]() H2CO3 K=10-2.8
H2CO3 K=10-2.8
②H2CO3![]() H++HCO3- K1=10-3.5,
H++HCO3- K1=10-3.5,
③HCO3-![]() H++CO32- K2=10-10.3,
H++CO32- K2=10-10.3,
若溶液中。c(CO2)=1.0×10-5mol/L,且忽略水的电离及H2CO3的第二级电离,则溶液pH=_____。
(3)某化学小组为了测量湖水中无机碳的含量,量取 100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收,将吸收液用0.10mol/L盐酸滴定,生成的V(CO2)随V (盐酸)变化关系如图2所示,则吸收液中离子浓度由大到小的顺序为______________(不用写出H+),湖水中无机碳的浓度为_______mol/L。

(4)—定条件下,CO2和H2O可以转化为CO和H2,通过反应:CO(g)+2H2(g) ![]() CH3OH(g)制备甲醇,若起始时在密闭容器中按物质的量之比1:2充入CO和H2,测得平衡时CO转化率a (CO)随T、P的变化关系如图3所示。
CH3OH(g)制备甲醇,若起始时在密闭容器中按物质的量之比1:2充入CO和H2,测得平衡时CO转化率a (CO)随T、P的变化关系如图3所示。

①P1__P2(填“大于”、“小于”或“等于”);
②该反应在195℃、P2条件下达到平衡后,c(H2)=0.5 mol/L ,则该反应的平衡常数为______。
③已知CH3OH和CO的燃烧热分别725.8kJ/mol、283.0 kJ/mol,1mol液态水变成气态水吸热44.0kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_________________。
(5)用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图4,则c电极的反应方程式为:_______________ 。

【答案】 CO2+CaCO3+H2O=Ca2++2HCO3- 5.65 c(Na+)>c(OH-)>c(CO32-)>c(HCO3-) 0.01 小于 4 CH3OH(l)+O2(g)=CO(g)+2H2O(g) ΔH=-354.8kJ∕mol CH3OH-6e- +H2O = CO2 +6H+
【解析】 (1)根据图示,碳酸钙与二氧化碳反应生成HCO3-的离子方程式为CO2+CaCO3+H2O=Ca2++2HCO3-,故答案为:CO2+CaCO3+H2O=Ca2++2HCO3-;
(2)设溶液pH为x,根据①CO2(g)+H2O![]() H2CO3 K=10-2.8,②H2CO3
H2CO3 K=10-2.8,②H2CO3![]() H++HCO3- K1=10-3.5,c(CO2)=1.0×10-5mol/L,则K=10-2.8=
H++HCO3- K1=10-3.5,c(CO2)=1.0×10-5mol/L,则K=10-2.8=![]() ,K1=10-3.5=
,K1=10-3.5=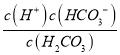 ,因此K×K1=
,因此K×K1=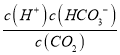 =
=![]() =10-6.3,解得x=5.65,故答案为:5.65;
=10-6.3,解得x=5.65,故答案为:5.65;
(3)根据图像,先后发生的反应为:①OH-+ H+= H2O;②CO32-+ H+= HCO3-;③HCO3-+ H+= CO2 ↑+ H2O,反应③中消耗盐酸10mL,说明含有HCO30.001mol,说明反应②中消耗盐酸10mL,反应①中消耗盐酸10mL,说明含有OH-0.001mol,因此吸收液中含有0.001molNaOH和0.001molNa2CO3,吸收液中离子浓度由大到小的顺序为c(Na+)>c(OH-)>c(CO32-)>c(HCO3-),湖水中无机碳的浓度为![]() = 0.01mol/L,故答案为:c(Na+)>c(OH-)>c(CO32-)>c(HCO3-) ;0.01;
= 0.01mol/L,故答案为:c(Na+)>c(OH-)>c(CO32-)>c(HCO3-) ;0.01;
(4)①根据CO(g)+2H2(g) ![]() CH3OH(g),相同温度条件下,压强越大,CO的转化率越大,根据图像,P1<P2,故答案为:小于;
CH3OH(g),相同温度条件下,压强越大,CO的转化率越大,根据图像,P1<P2,故答案为:小于;
②起始时在密闭容器中按物质的量之比1:2充入CO和H2,平衡后,c(H2)=0.5 mol/L ,则c(CO)=0.25 mol/L ,c(CH3OH)=0.25 mol/L ,该反应的平衡常数K=![]() =4,故答案为:4;
=4,故答案为:4;
③由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJmol-1和-725.8kJmol-1,1mol液态水变成气态水吸热44.0kJ,则①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJmol-1 ,②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-725.8kJmol-1 ,③H2O(l)= H2O(g) ΔH=+44.0kJ∕mol,由盖斯定律可知用②-①+③得反应
(5)根据电子移动的方向,c为负极,甲醇具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+。


科目:高中化学 来源: 题型:
【题目】某有机物A分子式为CxHyOz,15g A完全燃烧生成22g CO2和9gH2O。
(1)该有机物的最简式是___________________。
(2)若A是一种无色具存强烈剌激性气味的气体,具有还原性,则其结构简式是_________。
(3)A中只有一种官能团,若A和Na2CO3混合有气体放出,和醇能发生酯化反应,则A的结构简式为___________________。
(4)A中只有一种宫能团,若A是易挥发有水果香味的液体,能发生水解反应,则其结构简式为___________________。
(5)若A其分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式方程式中正确的是
A.NaHCO3溶液中HCO3-水解:HCO3-+ H2O ![]() H2CO3+OH-
H2CO3+OH-
B.AlCl3溶液中Al3+水解:Al3++3H2O = Al(OH)3↓+3H+
C.NaHS溶液中HS-水解:HS-+H2O ![]() H3O++S2-
H3O++S2-
D.碳酸溶液中H2CO3的电离:H2CO3 ![]() 2H++ CO32-
2H++ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为Fe2O3(s)+CO(g) ![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如右表所示:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH____(填“>”“<”或“=”)0.
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=____、CO的平衡转化率=____.
(3)欲提高(2)中CO的平衡转化率,可采取的措施是____.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)1000℃时,某时刻CO2和CO的物质的量浓度分别为0.2mol·L-1和0.1mol·L-1,则此时反应是否达到平衡_____(填“是”或“否”),V(正)_____V(逆)(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是

A. a极为电池的正极
B. 电池正极的电极反应为:4H++O2+4e﹣═2H2O
C. 电池工作时电流由a极沿导线经灯泡再到b极
D. 电池工作时,1mol乙醇被氧化时就有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是绿色、环保型水处理剂,也是高能电池的电极材料。工业上利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:

回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式______________。
(2)制备铁黄的离子方程式为_______________。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择_________;pH大于4.5时铁黄产率逐渐降低的主要原因可能是_______________。

(3)用高铁酸钾作水处理剂除了可以对水体进行杀菌消毒之外,其还原产物氢氧化铁胶体还能吸附水中悬浮杂质,请写出用高铁酸钾除去水体中CN﹣的离子方程式______。
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10﹣38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=_________molL﹣1。
(5)如果上述流程中,铁元素总利用率为75%。利用1L 2molL﹣1FeSO4溶液能制备纯度为90%的高铁酸钾________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粘氯酸用于合成广谱高效新型杀螨剂哒螨酮、除草剂苯钠松,也用于医药磺胺吡啶和感光材料的合成,其结构简式如图所示。下列有关粘氯酸的说法不正确的是

A. 分子式为C4H2Cl2O3
B. 能使酸性高锰酸钾溶液褪色
C. 1mol粘氯酸与足量NaHCO3溶液反应,能产生标准状况下22.4LCO2
D. 粘氯酸与足量H2反应生成M,则含一个甲基的M的同分异构体只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中,金属元素大多以化合态存在,通过金属冶炼得到金属单质。
工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但生产钾是用金属钠和熔化的KCl在一定的条件下反应制取:
KCl + Na![]() NaCl + K + Q (Q<0)
NaCl + K + Q (Q<0)
有关数据如下表:
熔点℃ | 沸点℃ | 密度 (g/cm3) | |
Na | 97.8 | 882.9 | 0.97 |
K | 63.7 | 774 | 0.86 |
NaCl | 801 | 1413 | 2.165 |
KCl | 770 | 1500 | 1.984 |
(1)请结合平衡移动理论分析,为什么能用该反应制备金属钾。
_______________________________________。
(2)在常压下金属钾转为气态从反应混合物中分离的最低温度约为_____℃,而反应的最高温度应低于_____℃。
(3)在制取金属钾的过程中,为了提高原料的转化率可采取的措施有__________。(任写两点)
(4)相比于电解熔融氯化钾,此方法的优点有_____________________。
(5)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为![]() ________。
________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com