
【题目】高铁酸钾是绿色、环保型水处理剂,也是高能电池的电极材料。工业上利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:

回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式______________。
(2)制备铁黄的离子方程式为_______________。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择_________;pH大于4.5时铁黄产率逐渐降低的主要原因可能是_______________。

(3)用高铁酸钾作水处理剂除了可以对水体进行杀菌消毒之外,其还原产物氢氧化铁胶体还能吸附水中悬浮杂质,请写出用高铁酸钾除去水体中CN﹣的离子方程式______。
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10﹣38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=_________molL﹣1。
(5)如果上述流程中,铁元素总利用率为75%。利用1L 2molL﹣1FeSO4溶液能制备纯度为90%的高铁酸钾________g。
【答案】 NaCl+H2O![]() NaClO+H2↑ 12Fe2++3O2+2H2O=4FeOOH+8Fe3+ 40℃ 酸性减弱,Fe (OH) 3增多 l0FeO42-+6CN-+22H2O=l0Fe (OH) 3 (胶体) +6CO32-+3N2↑+140H+ pH=2时, c(OH-) =10-12mol/L,根据 KspLFe(OH)3]=4.0×10-38,c (Fe3+)=0.04mol/L 330g
NaClO+H2↑ 12Fe2++3O2+2H2O=4FeOOH+8Fe3+ 40℃ 酸性减弱,Fe (OH) 3增多 l0FeO42-+6CN-+22H2O=l0Fe (OH) 3 (胶体) +6CO32-+3N2↑+140H+ pH=2时, c(OH-) =10-12mol/L,根据 KspLFe(OH)3]=4.0×10-38,c (Fe3+)=0.04mol/L 330g
【解析】(1)电解饱和食盐水制取次氯酸钠的化学方程式为NaCl+H2O![]() NaClO+H2↑;(2)硫酸亚铁与氧气反应生成铁黄(FeOOH)的反应中氧化剂为氧气,还原剂为硫酸亚铁,反应中铁的化合价由+2合成+3价,O元素的化合价由0价变成-2价,根据得失电子守恒,氧化剂和还原剂的物质的量之比为
NaClO+H2↑;(2)硫酸亚铁与氧气反应生成铁黄(FeOOH)的反应中氧化剂为氧气,还原剂为硫酸亚铁,反应中铁的化合价由+2合成+3价,O元素的化合价由0价变成-2价,根据得失电子守恒,氧化剂和还原剂的物质的量之比为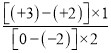 =
=![]() ,反应的离子方程式为12Fe2++3O2+2H2O=4FeOOH+8Fe3+。根据图像,40℃左右时,铁黄产率较高;pH大于4.5时生成了氢氧化铁,使得铁黄产率降低;(3)高铁酸钾具有氧化性,可以将CN-氧化为氮气和二氧化碳而除去,本身被还原为氢氧化铁胶体,在碱性溶液中二氧化碳变成碳酸根离子,反应的方程式为10FeO42-+6CN-+22H2O=10Fe(OH)3(胶体)+6CO32-+3N2↑+14OH-;(4)pH=2时,c(OH-)=10-12mol/L,根据Kap[Fe(OH)3]=4.0×10-38, c(Fe3+)=
,反应的离子方程式为12Fe2++3O2+2H2O=4FeOOH+8Fe3+。根据图像,40℃左右时,铁黄产率较高;pH大于4.5时生成了氢氧化铁,使得铁黄产率降低;(3)高铁酸钾具有氧化性,可以将CN-氧化为氮气和二氧化碳而除去,本身被还原为氢氧化铁胶体,在碱性溶液中二氧化碳变成碳酸根离子,反应的方程式为10FeO42-+6CN-+22H2O=10Fe(OH)3(胶体)+6CO32-+3N2↑+14OH-;(4)pH=2时,c(OH-)=10-12mol/L,根据Kap[Fe(OH)3]=4.0×10-38, c(Fe3+)= mol/L=0.04mol/L;
mol/L=0.04mol/L;
(5)1L 2mol·L-1FeSO4溶液中含有2mol FeSO4,根据铁元素守恒,生成高铁酸钾的质量=2mol×75%×198g/mol÷90%=330g。


科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO2+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃

请回答:
⑴仪器A的作用是_____;冰水浴冷却的目的是_____(写出两种)。
⑵空气流速过快或过慢,均降低NaClO2产率,试解释其原因______。
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①_____(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
(4) H2O2浓度对反应速率有影响。通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是______,馏出物是_______。

(5)抽滤法分离NaClO2过程中,下列操作不正确的是_______
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐是一类常见物质,下列物质可直接形成盐的是( )
①金属②碱性氧化物③碱 ④非金属⑤酸性氧化物⑥酸
A. 只有①②③ B. 只有①④⑥ C. 只有②⑤⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡状态的标志是
2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO
②单位时间内生成n molO2的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
A. ①③⑤ B. ②④⑥ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,试回答下列问题:
(1)某处碳循环如图所示,CaCO3转化为HCO3-的离子方程式为_____________。

(2)常温常压下,空气中的CO2溶于水,达到平衡时,无机碳在浓液中以4种形式存在,其转化关系如下:
①CO2(g)+H2O![]() H2CO3 K=10-2.8
H2CO3 K=10-2.8
②H2CO3![]() H++HCO3- K1=10-3.5,
H++HCO3- K1=10-3.5,
③HCO3-![]() H++CO32- K2=10-10.3,
H++CO32- K2=10-10.3,
若溶液中。c(CO2)=1.0×10-5mol/L,且忽略水的电离及H2CO3的第二级电离,则溶液pH=_____。
(3)某化学小组为了测量湖水中无机碳的含量,量取 100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收,将吸收液用0.10mol/L盐酸滴定,生成的V(CO2)随V (盐酸)变化关系如图2所示,则吸收液中离子浓度由大到小的顺序为______________(不用写出H+),湖水中无机碳的浓度为_______mol/L。

(4)—定条件下,CO2和H2O可以转化为CO和H2,通过反应:CO(g)+2H2(g) ![]() CH3OH(g)制备甲醇,若起始时在密闭容器中按物质的量之比1:2充入CO和H2,测得平衡时CO转化率a (CO)随T、P的变化关系如图3所示。
CH3OH(g)制备甲醇,若起始时在密闭容器中按物质的量之比1:2充入CO和H2,测得平衡时CO转化率a (CO)随T、P的变化关系如图3所示。

①P1__P2(填“大于”、“小于”或“等于”);
②该反应在195℃、P2条件下达到平衡后,c(H2)=0.5 mol/L ,则该反应的平衡常数为______。
③已知CH3OH和CO的燃烧热分别725.8kJ/mol、283.0 kJ/mol,1mol液态水变成气态水吸热44.0kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_________________。
(5)用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图4,则c电极的反应方程式为:_______________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物F 和J的合成路线如下:

已知:
1 乙烯醇不稳定,会迅速转化为乙醛
2 CH2=CH2+1/2O2+CH3COOH-----CH2=CHOOCCH3+H2O
3 
(1)G中官能团的名称是_________________。
(2)C的结构简式是_____________________。
(3)芳香烃D的一氯代物只有两种,则D的结构简式是___________________。
(4)反应③的反应类型是___________________。
(5)反应②和⑤的化学方程式分别是:
反应②_________________;_______________
反应⑤_________________________________。
(6) E也可由A和2,4-己二烯为原料制备,请写出该合成路线______________(无机试剂任选)。
E也可由A和2,4-己二烯为原料制备,请写出该合成路线______________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)

实验步骤如下:
①配制浓硫酸和浓硝酸的混合物(混酸);
②在三颈烧瓶里装15 mL甲苯(密度为0.866 g·cm-3);
③装好其他药品,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈烧瓶底有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯,经提纯最终得到一硝基甲苯共15 g.
根据上述实验,回答下列问题:
(1)本实验的关键是控制温度在30℃左右,如果温度过高,则会产生__________等副产品(填物质名称)
(2)简述配制混酸的方法:____________________.
(3)A仪器名称是__________,进水口是__________.
(4)写出甲苯与混酸反应生成对硝基甲苯的化学方程式:___________________________.
(5)分离产品方案如下:

操作2的名称是___________.经测定,产品2的核磁共振氢谱中有5个峰,它的名称为___________.
(6)本实验中一硝基甲苯的产率为___________ (结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里做钠跟水反应的实验时,用到的仪器和药品是:①试管夹、②镊子、③小刀、④滤纸、⑤研钵、⑥烧杯、⑦坩埚、⑧石棉网、⑨玻璃片、⑩药匙.
A.①②③④ B.②③④⑥⑨ C.③④⑧⑨⑩ D.②⑤⑦⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生命物质的重要组成元素之一,含氮物质与人类的生活密切相关。
(1)氮原子最外层电子排布式为:_________;氮离子![]() 核外有___种运动状态不同的电子;N4分子的空间结构如图:
核外有___种运动状态不同的电子;N4分子的空间结构如图:![]() ,它是一种_____分子。(填“极性”或“非极性”)
,它是一种_____分子。(填“极性”或“非极性”)
(2)氨气是人工固氮的产物,它极易溶于水(![]() ),生成NH3 · H2O。请设计实验证明NH3 · H2O是弱碱_______________________________。
),生成NH3 · H2O。请设计实验证明NH3 · H2O是弱碱_______________________________。
(3)向100mL 0.1mol/L的盐酸中通入0.02mol氨气,充分吸收后测得溶液呈碱性。则该溶液中NH3 · H2O、![]() 、
、![]() 三种微粒的物质的量浓度大小关系为____________。
三种微粒的物质的量浓度大小关系为____________。
(4)铵盐可用作氮肥,实验室检验铵盐中的![]() 时,可取少量铵盐样品于试管中,加入强碱浓溶液,加热,若产生的气体能使________________________________,说明有
时,可取少量铵盐样品于试管中,加入强碱浓溶液,加热,若产生的气体能使________________________________,说明有![]() 。
。
(5)NaN3可用于制造汽车安全气囊,当汽车遇到撞击时,NaN3能迅速分解产生Na和N2。请写出该反应的化学方程式_______________________,每生成3mol N2时,转移电子_____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com