
【题目】实验室里做钠跟水反应的实验时,用到的仪器和药品是:①试管夹、②镊子、③小刀、④滤纸、⑤研钵、⑥烧杯、⑦坩埚、⑧石棉网、⑨玻璃片、⑩药匙.
A.①②③④ B.②③④⑥⑨ C.③④⑧⑨⑩ D.②⑤⑦⑨⑩
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A.不能让小学生咬铅笔头,否则会引起铅中毒
B.食用碱用于面包加工,可以使面包疏松
C .铝合金用作门窗框架,这是利用了合金硬度大的特征
D.烧碱和冰醋酸均为电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是绿色、环保型水处理剂,也是高能电池的电极材料。工业上利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:

回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式______________。
(2)制备铁黄的离子方程式为_______________。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择_________;pH大于4.5时铁黄产率逐渐降低的主要原因可能是_______________。

(3)用高铁酸钾作水处理剂除了可以对水体进行杀菌消毒之外,其还原产物氢氧化铁胶体还能吸附水中悬浮杂质,请写出用高铁酸钾除去水体中CN﹣的离子方程式______。
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10﹣38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=_________molL﹣1。
(5)如果上述流程中,铁元素总利用率为75%。利用1L 2molL﹣1FeSO4溶液能制备纯度为90%的高铁酸钾________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1mol·L-1H3PO2溶液中滴加0.1mol·L-1的NaOH溶液,滴定曲线如图1,含磷微粒物质的量浓度所占分数(δ)随pH变化关系如图2。下列说法不正确是

A. H3PO2的电离方程式为H3PO2![]() H2PO2-+H+ Ka≈10-5
H2PO2-+H+ Ka≈10-5
B. B点时,溶液中存在关系:2c(H+)+c(H2PO2-)=2c(OH-)+c(H3PO2)
C. C点时,溶液中存在关系:c(Na+)+c(H+)=C(H2PO2-)+c(OH-)
D. D点时,溶液中微粒浓度大小关系:c(Na+)>c(H2PO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粘氯酸用于合成广谱高效新型杀螨剂哒螨酮、除草剂苯钠松,也用于医药磺胺吡啶和感光材料的合成,其结构简式如图所示。下列有关粘氯酸的说法不正确的是

A. 分子式为C4H2Cl2O3
B. 能使酸性高锰酸钾溶液褪色
C. 1mol粘氯酸与足量NaHCO3溶液反应,能产生标准状况下22.4LCO2
D. 粘氯酸与足量H2反应生成M,则含一个甲基的M的同分异构体只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从香荚兰豆中提取的一种芳香化合物,其分子式为C8H8O3,遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该化合物可能的结构简式是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 摩尔是表示物质微粒数的单位
B. H2SO4的摩尔质量是98g
C. 标准状况下,1mol任何物质的体积都约为22.4L
D. 一定温度、压强下,气体体积由其分子数目的多少决定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生。一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g。下列有关说法中正确的是
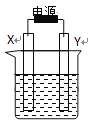
A. X电极连接电源正极
B. 生成气体体积为0.56L
C. Y电极上发生氧化反应
D. 该CuCl2溶液浓度为0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)①氯胺(NH2Cl)的电子式为_______。
②工业上可利用Cl2和NH3反应制备氯胺,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol·L-1 NaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | x |
2 | 1.0 | 2.00 | y |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为__________。
(3)用焦炭还原NO的反应为:2NO(g) + C(s) ![]() N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/ml | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
②该反应的ΔH___0 (填“>”或“<”)。
③丙容器达到平衡时,NO的转化率为___________。
(4)常温下,在NH4HCO3溶液中,c(NH4+)________c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O ![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com