
【题目】下列叙述正确的是
A. 摩尔是表示物质微粒数的单位
B. H2SO4的摩尔质量是98g
C. 标准状况下,1mol任何物质的体积都约为22.4L
D. 一定温度、压强下,气体体积由其分子数目的多少决定
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】盐是一类常见物质,下列物质可直接形成盐的是( )
①金属②碱性氧化物③碱 ④非金属⑤酸性氧化物⑥酸
A. 只有①②③ B. 只有①④⑥ C. 只有②⑤⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)

实验步骤如下:
①配制浓硫酸和浓硝酸的混合物(混酸);
②在三颈烧瓶里装15 mL甲苯(密度为0.866 g·cm-3);
③装好其他药品,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈烧瓶底有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯,经提纯最终得到一硝基甲苯共15 g.
根据上述实验,回答下列问题:
(1)本实验的关键是控制温度在30℃左右,如果温度过高,则会产生__________等副产品(填物质名称)
(2)简述配制混酸的方法:____________________.
(3)A仪器名称是__________,进水口是__________.
(4)写出甲苯与混酸反应生成对硝基甲苯的化学方程式:___________________________.
(5)分离产品方案如下:

操作2的名称是___________.经测定,产品2的核磁共振氢谱中有5个峰,它的名称为___________.
(6)本实验中一硝基甲苯的产率为___________ (结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里做钠跟水反应的实验时,用到的仪器和药品是:①试管夹、②镊子、③小刀、④滤纸、⑤研钵、⑥烧杯、⑦坩埚、⑧石棉网、⑨玻璃片、⑩药匙.
A.①②③④ B.②③④⑥⑨ C.③④⑧⑨⑩ D.②⑤⑦⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于药物的说法不正确的是
A. OTC表示非处方药
B. 氢氧化铝是抗酸药的主要成分
C. 麻黄碱可用于治疗支气管哮喘
D. 青霉索是重要的抗生索,可以放心大量使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。
请回答下列问题:
(1)①与氧同周期的相邻元素及氧的第一电离能由大到小的顺序为________________。
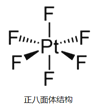
②已知:离子型配位化合物O2[PtF6]中铂元素为+ 5价,它可由反应PtF6+O2= O2[PtF6]制得,PtF6分子结构如图所示。PtF6分子中Pt的杂化轨道类型是否为sp3?答:_____(填“是”或“否”),其原因是_______。
(2)臭鼬排放的臭气主要成分为3-MBT(3-甲基-2-丁烯硫醇,结构简式为![]() )。1mol3-MBT中含有σ键数目为_______(NA为阿伏伽德罗常数的值)。沸点:3-MBT____(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是_______________________。
)。1mol3-MBT中含有σ键数目为_______(NA为阿伏伽德罗常数的值)。沸点:3-MBT____(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是_______________________。
(3)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是_____(填字母)。
A.中心原子的价层电子对数目相等
B.都是极性分子
C.中心原子的孤对电子数目相等
D.都含有极性键
②SO3子的空间构型为________,与其互为等电子体的阴离子为_____(举一例)。
(4)元素X与硒同周期,且该周期中X元素原子核外未成对电子数最多,则X为____基态原子的电子排布式为_______。
(5)单质钋是由_____键形成的晶体,其晶胞为简单立方;若已知Po的摩尔质量为Mg·mol-1,原子半径为rpm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为_____g·cm-3(只列表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生命物质的重要组成元素之一,含氮物质与人类的生活密切相关。
(1)氮原子最外层电子排布式为:_________;氮离子![]() 核外有___种运动状态不同的电子;N4分子的空间结构如图:
核外有___种运动状态不同的电子;N4分子的空间结构如图:![]() ,它是一种_____分子。(填“极性”或“非极性”)
,它是一种_____分子。(填“极性”或“非极性”)
(2)氨气是人工固氮的产物,它极易溶于水(![]() ),生成NH3 · H2O。请设计实验证明NH3 · H2O是弱碱_______________________________。
),生成NH3 · H2O。请设计实验证明NH3 · H2O是弱碱_______________________________。
(3)向100mL 0.1mol/L的盐酸中通入0.02mol氨气,充分吸收后测得溶液呈碱性。则该溶液中NH3 · H2O、![]() 、
、![]() 三种微粒的物质的量浓度大小关系为____________。
三种微粒的物质的量浓度大小关系为____________。
(4)铵盐可用作氮肥,实验室检验铵盐中的![]() 时,可取少量铵盐样品于试管中,加入强碱浓溶液,加热,若产生的气体能使________________________________,说明有
时,可取少量铵盐样品于试管中,加入强碱浓溶液,加热,若产生的气体能使________________________________,说明有![]() 。
。
(5)NaN3可用于制造汽车安全气囊,当汽车遇到撞击时,NaN3能迅速分解产生Na和N2。请写出该反应的化学方程式_______________________,每生成3mol N2时,转移电子_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中,按熔点由高到低的顺序排列正确的是
A. CH4>SiH4>GeH4>SnH4 B. KCl>NaCl>MgCl2>MgO
C. Rb>B>Na>Li D. 金刚石>Si>钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com