
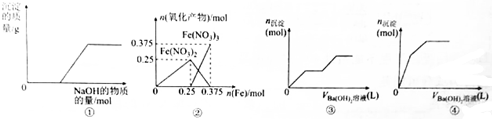
| A. | 图①表示向Ca(HCO3)2溶液中滴加NaOH溶液时,产生沉淀的质量与加入NaOH的物质的量之间的关系 | |
| B. | 图②表示向n(HNO3)=1mol的稀HNO3中加入Fe时,氧化产物(还原产物为NO)的物质的量与Fe的物质的量之间的关系 | |
| C. | 图③可用来表示向含有4mol HCl和1mol MgSO4的混合溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 | |
| D. | 图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 |
分析 A.Ca(HCO3)2溶液中滴加NaOH溶液,开始即生成沉淀;
B.稀HNO3中加入Fe时,开始先生成3Fe(NO3)3,Fe过量生成3Fe(NO3)2;
C.向含有4mol HCl和1mol MgSO4的混合溶液中滴加Ba(OH)2溶液时,先产生的沉淀只是BaSO4,然后是中和反应,最后是与Mg2+产生沉淀Mg(OH)2;
D.先发生的反应是2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4,然后2Al(OH)3+K2SO4+Ba(OH)2=2KAlO2+BaSO4↓+H2O,即沉淀达最多后溶解一部分(5mol→4mol).
解答 解:A.Ca(HCO3)2溶液中滴加NaOH溶液,开始即生成沉淀,图象中开始没有沉淀,故A错误;
B.稀HNO3中加入Fe时,开始先生成3Fe(NO3)3,Fe过量生成3Fe(NO3)2,发生反应为Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O,2Fe(NO3)3+Fe═3Fe(NO3)2,图象不符,故B错误;
C.向含有4mol HCl和1mol MgSO4的混合溶液中滴加Ba(OH)2溶液时,先发生酸碱中和反应,然后是中和反应,最后是与Mg2+产生沉淀Mg(OH)2,故C正确;
D.向一定质量的明矾溶液中滴加Ba(OH)2溶液时,先发生的反应是2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4,然后2Al(OH)3+K2SO4+Ba(OH)2=2KAlO2+BaSO4↓+H2O,即沉淀达最多后溶解一部分(5mol→4mol),即图象中沉淀的量先增多,后减少,最后不变,故D错误;
故选C.
点评 本题考查物质之间的反应,明确离子反应先后顺序是解本题关键,侧重于考查学生的分析能力和读图能力,题目难度中等.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 用途 | 解释 |
| A | Al2O3 | 耐火材料 | Al2O3的熔沸点较高 |
| B | SiO2 | 计算机芯片 | SiO2是一种良好的半导体 |
| C | Fe3O4 | 红色涂料 | Fe3O4是一种红色氧化物 |
| D | 浓H2SO4 | 干燥剂 | 浓H2SO4有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前 v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3 的转化率小于80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com