
| A. | 氯化钡 | B. | 硫酸铜 | C. | 硝酸钾 | D. | 氯酸钾 |
分析 A、BaCl2是强酸强碱盐,在溶液中电离为Ba2+和Cl-;
B、CuSO4是强酸弱碱盐,在溶液中电离为Cu2+和SO42-;
C、KNO3能电离为K+和NO3-;
D、KClO3能电离为K+和ClO3-.
解答 解:A、BaCl2是强酸强碱盐,在溶液中电离为Ba2+和2个Cl-,且在溶液中均不水解,故阴离子与阳离子的物质的量之比为2:1,故A正确;
B、CuSO4是强酸弱碱盐,在溶液中电离为Cu2+和SO42-,由于Cu2+是弱碱阳离子,在溶液中会水解,故溶液中阴离子与阳离子的物质的量之比大于1:1,故B错误;
C、KNO3能电离为K+和NO3-,且均不水解,故阴离子与阳离子的物质的量之比1:1,故C错误;
D、KClO3能电离为K+和ClO3-,且均不水解,故阴离子与阳离子的物质的量之比1:1,故D错误;
故选A.
点评 本题考查了电解质在水溶液中的电离,应注意盐类的水解对离子个数的影响,难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、CaCO3 | B. | CaCO3、Cl2 | C. | Cl2、Ca(OH)2 | D. | Ca(OH)2、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
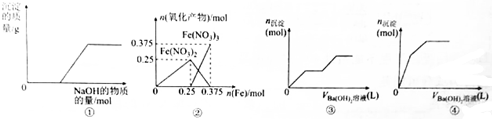
| A. | 图①表示向Ca(HCO3)2溶液中滴加NaOH溶液时,产生沉淀的质量与加入NaOH的物质的量之间的关系 | |
| B. | 图②表示向n(HNO3)=1mol的稀HNO3中加入Fe时,氧化产物(还原产物为NO)的物质的量与Fe的物质的量之间的关系 | |
| C. | 图③可用来表示向含有4mol HCl和1mol MgSO4的混合溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 | |
| D. | 图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是熵减小的反应,而反应②是熵增大的反应 | |
| B. | 反应②高温时能自发迸行.是由于生成CO2使熵值增大 | |
| C. | 上述事实说明的H2SiO3酸性有时比H2CO3强,有时比H2CO3弱 | |
| D. | H2CO3酸性强于H2SiO3,不能用反应②进行解释 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com