
【题目】下面是你熟悉的物质:
![]() 、金刚石、
、金刚石、 ![]()
![]() 这些物质中,只含离子键的是______
这些物质中,只含离子键的是______
![]() 既含共价键又含离子键的是______
既含共价键又含离子键的是______
![]() 如果将
如果将![]() 溶于水,破坏了
溶于水,破坏了![]() 中化学键的类型为______。
中化学键的类型为______。
【答案】NaBr、![]()
![]() 、
、![]() 离子键、共价键
离子键、共价键
【解析】
一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答。
![]() 分子中O原子之间只存在共价键;
分子中O原子之间只存在共价键;
![]() 金刚石中C原子之间只存在共价键;
金刚石中C原子之间只存在共价键;
![]() 中钠离子和溴离子之间只存在离子键;
中钠离子和溴离子之间只存在离子键;
![]() 中组成元素全是非金属元素,H2SO4分子中只存在共价键;
中组成元素全是非金属元素,H2SO4分子中只存在共价键;
![]() 中钠离子和碳酸根离子之间存在离子键,CO32-中C、O原子之间存在共价键;
中钠离子和碳酸根离子之间存在离子键,CO32-中C、O原子之间存在共价键;
![]() 中钠离子和硫离子之间存在离子键;
中钠离子和硫离子之间存在离子键;
![]() 中钠离子和硫酸氢根离子之间存在离子键、HSO4-中原子之间存在共价键;
中钠离子和硫酸氢根离子之间存在离子键、HSO4-中原子之间存在共价键;
![]() 这些物质中,只含离子键的是NaBr、
这些物质中,只含离子键的是NaBr、![]() ,故答案为:NaBr、
,故答案为:NaBr、![]() ;
;
![]() 既含共价键又含离子键的是
既含共价键又含离子键的是![]() 、
、![]() ,故答案为:
,故答案为:![]() 、
、![]() ;
;
![]() 将
将![]() 溶于水,NaHSO4电离出Na+、H+、SO42-,所以破坏了
溶于水,NaHSO4电离出Na+、H+、SO42-,所以破坏了![]() 中化学键的类型为离子键、共价键,故答案为:离子键、共价键。
中化学键的类型为离子键、共价键,故答案为:离子键、共价键。


科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:

回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_______。
(2)能够提高“碱浸”效率的方法有______(至少写两种)。
(3)“碱浸”过程中,铝溶解的离子方程式为_____。
(4)实验室模拟“碱浸”后过滤的操作,需用到的玻璃仪器有_____;过滤后需洗涤,简述洗涤的操作过程:_____。
(5)LiCoO2参与“还原”反应的离子方程式为_______。
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示:

则浸出过程的最佳条件是______。
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为______(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g2=0.3,溶液体积变化忽略不计)。
(8)写出“高温烧结固相合成”过程的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂化可得到有机物(CH3)2C=C(CH3)2(以下用A表示)。
(1)A的系统命名为________;A在通常状况下呈________(填“气”“液”或“固”)态。
(2)A与Br2的加成产物B与NaOH的乙醇溶液共热可生成二烯烃C,则C的结构简式为___________________;B生成C的反应类型为________。
(3)C与一定量Br2反应可能生成D、E和G,而D与HBr的加成产物只有F,则D形成高分子化合物的化学方程式为__________________________________________。
(4)C的同分异构体中不可能为________(填字母)
a.芳香烃 b.炔烃 c.环烯烃 d.二烯烃
若C的一种同分异构体H与KMnO4酸性溶液生成己二酸,则H的结构简式为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
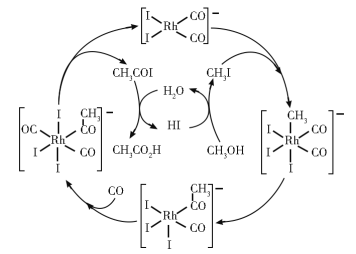
下列叙述错误的是
A.CH3COI是反应中间体
B.甲醇羰基化反应为CH3OH+CO=CH3CO2H
C.反应过程中Rh的成键数目保持不变
D.存在反应CH3OH+HI=CH3I+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图形象地表示了氯化钠的形成过程,下列相关叙述中,不正确的是( )

A. 钠原子易失去一个电子,氯原子易得到一个电子
B. 钠离子与钠原子有相似的化学性质
C. 钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D. 氯化钠是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=98 kJ·mol1。回答下列问题:
SO3(g) ΔH=98 kJ·mol1。回答下列问题:
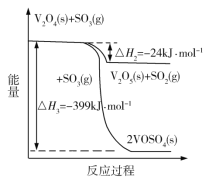
(1)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:_________。
(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α 随温度的变化如图所示。反应在5.0MPa、550℃时的α=__________,判断的依据是__________。影响α的因素有__________。

(3)将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
(4)研究表明,SO2催化氧化的反应速率方程为:v=k(![]() 1)0.8(1nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。
1)0.8(1nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。
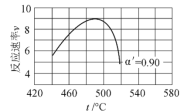
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。下列叙述错误的是
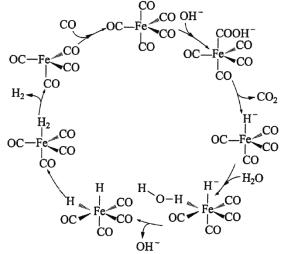
A.OH-参与了该催化循环B.该反应可产生清洁燃料H2
C.该反应可消耗温室气体CO2D.该催化循环中Fe的成键数目发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学发布了三份无色溶液检测报告,结果如下(水电离的H+、OH-忽略不计):
溶液(1)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cu2+ | 0.2 |
Ba2+ | 0.5 | NO3- | 1.5 |
Mg2+ | 0.3 | Cl- | 0.6 |
溶液(2)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cl- | 0.9 |
Ag+ | 0.5 | NO3- | 0.3 |
Mg2+ | 0.3 |
溶液(3)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cl- | 0.2 |
K+ | 0.5 | NO3- | 0.3 |
Mg2+ | 0.3 | SO42- | 0.4 |
试分析判断:上述三份检测结果是否可靠,若不可靠,说出理由。
I.溶液(1)结果是否可靠________,理由________。
溶液(2)结果是否可靠_________,理由________。
溶液(3)结果是否可靠_________,理由________。
II.乙同学对可能含有下列6种离子的溶液进行如下实验:Cl-,SO42-,NH4+,CO32-,K+,Na+;
已知:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
a.取200mL上述溶液,向其中加入足量BaCl2溶液,反应后将沉淀过滤,洗涤,干燥,得沉淀4.30g,向沉淀中加入足量的盐酸,有2.33g沉淀不溶。
b.向a的滤液中加入足量的NaOH溶液,加热,产生标况下的气体1.12L(假定气体全部逸出 )
(1)溶液中一定存在的离子有_____,可能存在的离子有_____。
(2)原溶液中![]() ___
___![]() ,
,![]() ___
___![]() (填“>”“<”“=”,下同)
(填“>”“<”“=”,下同)
(3)如果上述6种离子都存在,则![]() ____
____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:![]() 该电池工作时,下列说法错误的是
该电池工作时,下列说法错误的是

A.负载通过0.04 mol电子时,有0.224 L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为![]()
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com