
【题目】甲同学发布了三份无色溶液检测报告,结果如下(水电离的H+、OH-忽略不计):
溶液(1)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cu2+ | 0.2 |
Ba2+ | 0.5 | NO3- | 1.5 |
Mg2+ | 0.3 | Cl- | 0.6 |
溶液(2)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cl- | 0.9 |
Ag+ | 0.5 | NO3- | 0.3 |
Mg2+ | 0.3 |
溶液(3)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cl- | 0.2 |
K+ | 0.5 | NO3- | 0.3 |
Mg2+ | 0.3 | SO42- | 0.4 |
试分析判断:上述三份检测结果是否可靠,若不可靠,说出理由。
I.溶液(1)结果是否可靠________,理由________。
溶液(2)结果是否可靠_________,理由________。
溶液(3)结果是否可靠_________,理由________。
II.乙同学对可能含有下列6种离子的溶液进行如下实验:Cl-,SO42-,NH4+,CO32-,K+,Na+;
已知:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
a.取200mL上述溶液,向其中加入足量BaCl2溶液,反应后将沉淀过滤,洗涤,干燥,得沉淀4.30g,向沉淀中加入足量的盐酸,有2.33g沉淀不溶。
b.向a的滤液中加入足量的NaOH溶液,加热,产生标况下的气体1.12L(假定气体全部逸出 )
(1)溶液中一定存在的离子有_____,可能存在的离子有_____。
(2)原溶液中![]() ___
___![]() ,
,![]() ___
___![]() (填“>”“<”“=”,下同)
(填“>”“<”“=”,下同)
(3)如果上述6种离子都存在,则![]() ____
____![]() 。
。
【答案】不可靠 原溶液无色,不会含有Cu2+ 不可靠 Ag+和Cl-不可能共存 不可靠 分析结果中阴阳离子电荷不相等 Cl-、SO42-、NH4+、CO32- K+、Na+ 0.05 > >
【解析】
a.取200mL溶液,向其中加入足量BaCl2溶液有白色沉淀生成,再向沉淀中加入足量的盐酸,沉淀部分溶解,并有气体生成,说明沉淀是BaCO3和BaSO4,则溶液中含有SO42-、CO32-;
b.向a的滤液中加入足量的NaOH溶液,加热,产生气体,说明原溶液中含有NH4+。
I.溶液(1)中有Cu2+,Cu2+在溶液中呈蓝色,而题中说的是无色溶液,故溶液(1)结果不可靠;
溶液(2)中有Ag+和Cl-,但是Ag+和Cl-在溶液中不能大量共存,故溶液(2)的结果不可靠;
溶液(3),阳离子所带正电荷的总浓度为0.1mol/L+0.3mol/L+0.3mol/L×2=1mol/L;阴离子所带负电荷的总浓度为0.2mol/L+0.3mol/L+0.4mol/L×2=1.3mol/L,因此溶液不是电中性,所以溶液(3)的结果不可靠;
II.(1)a.取200mL溶液,向其中加入足量BaCl2溶液有白色沉淀生成,再向沉淀中加入足量的盐酸,沉淀部分溶解,并有气体生成,说明沉淀是BaCO3和BaSO4,沉淀质量共4.30g,则溶液中含有SO42-、CO32-,向沉淀中加入足量的盐酸,沉淀部分溶解,有2.33g沉淀不溶,则硫酸钡的质量是2.33g,所以n(SO42-)=n(BaSO4)=![]() =0.01mol,m(BaCO3)=4.3g-2.33g=1.97g,n(CO32-)=n(BaCO3)=
=0.01mol,m(BaCO3)=4.3g-2.33g=1.97g,n(CO32-)=n(BaCO3)=![]() =0.01mol,故c(CO32-)=0.01mol
=0.01mol,故c(CO32-)=0.01mol![]() 0.2L=0.05
0.2L=0.05![]() ,c(SO42-)=0.01mol
,c(SO42-)=0.01mol![]() 0.2L=0.05
0.2L=0.05![]() ;
;
(2)向a的滤液中加入足量的NaOH溶液,加热,产生标况下的气体体积是1.12L,该气体是NH3,n(NH3)=![]() =0.05mol,因为n(NH4+)=n(NH3),所以c(NH4+)=0.05mol
=0.05mol,因为n(NH4+)=n(NH3),所以c(NH4+)=0.05mol![]() 0.2L=0.25mol/L,故c(NH4+)>c(SO42-);
0.2L=0.25mol/L,故c(NH4+)>c(SO42-);
(3)由溶液呈电中性可知:n(NH4+)+n(K+)+n(Na+)=2n(SO42-)+2n(CO32-)+n(Cl-),则n(Cl-)=n(NH4+)+n(K+)+n(Na+)-2n(SO42-)-2n(CO32-)=0.05+n(K+)+n(Na+)-2×0.01-2×0.01=0.01+n(K+)+n(Na+)>0.01mol,c(Cl-)>![]() ,c(Cl-)0.05
,c(Cl-)0.05![]() ,故c(Cl-)>c(SO42-)。
,故c(Cl-)>c(SO42-)。


科目:高中化学 来源: 题型:
【题目】海洋是一个资源宝库,海水资源的开发和利用是现代和未来永恒的主题。下面是海水利用的流程图:
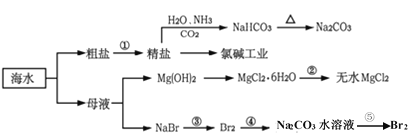
下列有关说法不正确的是
A.过程中制得NaHCO3是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生了使湿润淀粉碘化钾试纸变蓝的气体
C.反应②加热MgCl2·6H2O应在HCl气流保护下制备无水MgCl2
D.反应⑤中,用Na2CO3水溶液吸收Br2后,用70—80%硫酸富集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是你熟悉的物质:
![]() 、金刚石、
、金刚石、 ![]()
![]() 这些物质中,只含离子键的是______
这些物质中,只含离子键的是______
![]() 既含共价键又含离子键的是______
既含共价键又含离子键的是______
![]() 如果将
如果将![]() 溶于水,破坏了
溶于水,破坏了![]() 中化学键的类型为______。
中化学键的类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
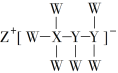
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NH3是工业生产中的常用气体,研究其在工业上的反应过程对提高生产效率尤为重要。
I.工业上用CO和H2做原料可以合成甲醇,作为液体燃料。已知:
① 2H2(g)+CO(g) +![]() O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
(1)请写出用CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:______________。
(2)一定温度下,在容积为2L的恒容容器中加入3mol H2和2mol CO,当反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的
CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的![]() ,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
II.对于氨的合成反应 N2(g)+3H2(g)![]() 2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
(3)恒容条件下,从开始反应到建立起平衡状态,v(N2)=_________;反应达到平衡后,第5分
钟末只改变反应温度,保持其它条件不变,则改变条件后NH3的物质的量浓度不可能为_____。
A. 0.20 mol/L B. 0.12 mol/L C. 0.10 mol/L D. 0.08 mol/L
(4)在第5分钟时将容器的体积缩小一半,反应在第8分钟时达到新的平衡,此时NH3的浓度约为0.30 mol/L。请在上图中画出第5分钟之后的NH3浓度的变化曲线______。
(5)其它条件不变,若只把容器改为恒压容器,加入0.2 molN2和0.6 molH2,达到平衡时,NH3的体积分数为m%。若向容器中继续加入0.2 molN2和0.6 molH2,,在同样的温度下达到平衡时,NH3的体积分数为n%,则m和n的关系正确的是______。
A.m>n B.m<n C.m=n D.无法比较%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O ①
2NO2+2NaOH=NaNO2+NaNO3+H2O ②
在反应①中,氧化剂是___,还原剂是___。在反应②中,氧化剂是__,还原剂是__。
(2)汽车尾气中含有二氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成氮气和二氧化碳,该反应的化学方程式为___。
(3)氨气亦可用来处理氮氧化物。例如,氨气与二氧化氮发生如下反应:6NO2+8NH3=7N2+12H2O。若某工厂排出的尾气中二氧化氮含量为0.5%(体积分数),处理1×103m3(标准状况)这种尾气,需要多少千克氨气___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.质谱、红外光谱都能够快速、精确地测定有机物的相对分子质量
B.核磁共振氢谱中,CH3COOH、CH3OH都可给出两种峰信号
C.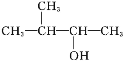 的名称为2-甲基-3-丁醇
的名称为2-甲基-3-丁醇
D.乙二醇和丙三醇互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下图所示。下列说法中,错误的是
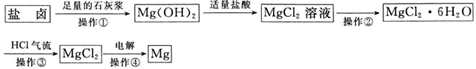
A.操作①发生的反应为非氧化还原反应
B.在实验室进行操作①时,只需要漏斗和烧杯两种玻璃仪器
C.操作②是蒸发浓缩、冷却结晶
D.在整个制备过程中未发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
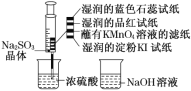
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、蘸有KMnO4溶液的滤纸均褪色都能证明SO2的漂白性
C.湿润的淀粉KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com