
【题目】CO、NH3是工业生产中的常用气体,研究其在工业上的反应过程对提高生产效率尤为重要。
I.工业上用CO和H2做原料可以合成甲醇,作为液体燃料。已知:
① 2H2(g)+CO(g) +![]() O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
(1)请写出用CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:______________。
(2)一定温度下,在容积为2L的恒容容器中加入3mol H2和2mol CO,当反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的
CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的![]() ,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
II.对于氨的合成反应 N2(g)+3H2(g)![]() 2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
(3)恒容条件下,从开始反应到建立起平衡状态,v(N2)=_________;反应达到平衡后,第5分
钟末只改变反应温度,保持其它条件不变,则改变条件后NH3的物质的量浓度不可能为_____。
A. 0.20 mol/L B. 0.12 mol/L C. 0.10 mol/L D. 0.08 mol/L
(4)在第5分钟时将容器的体积缩小一半,反应在第8分钟时达到新的平衡,此时NH3的浓度约为0.30 mol/L。请在上图中画出第5分钟之后的NH3浓度的变化曲线______。
(5)其它条件不变,若只把容器改为恒压容器,加入0.2 molN2和0.6 molH2,达到平衡时,NH3的体积分数为m%。若向容器中继续加入0.2 molN2和0.6 molH2,,在同样的温度下达到平衡时,NH3的体积分数为n%,则m和n的关系正确的是______。
A.m>n B.m<n C.m=n D.无法比较%
【答案】 2H2(g)+CO(g)=CH3OH(l) ΔH= +131.9kJ/mol 4 L2·mol-2 不 0.0125 mol/(L·min) AC 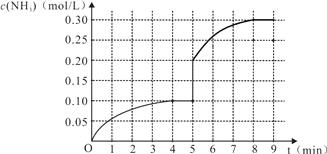 C
C
【解析】I. (1)已知:
① 2H2(g)+CO(g) +![]() O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
根据盖斯定律,由①-![]() ×②可得反应:2H2(g)+CO(g)=CH3OH(l) ΔH=ΔH1-
×②可得反应:2H2(g)+CO(g)=CH3OH(l) ΔH=ΔH1-![]() ×ΔH2 =-594.1kJ/mol -
×ΔH2 =-594.1kJ/mol -![]() ×(-1452kJ/mol)= +131.9kJ/mol;
×(-1452kJ/mol)= +131.9kJ/mol;
(2)达到平衡状态,测得容器内的压强是反应前压强的![]() ,设反应后生成的甲醇的物质的量为X,据此列方程求解:
,设反应后生成的甲醇的物质的量为X,据此列方程求解:
2H2(g)+CO(g)![]() CH3OH(g)
CH3OH(g)
起始量(mol) 3 2 0
变化量(mol) 2X X X
平衡量(mol) 3-2X 2-X X
根据测得容器内的压强是反应前压强的![]() 得,
得, ![]() =
=![]() ,X=1,
,X=1,
反应的平衡常数K=![]() =
=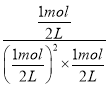 =4(L/mol)2,该反应的平衡常数为4(L/mol)2;
=4(L/mol)2,该反应的平衡常数为4(L/mol)2;
该反应的平衡常数表示式为:K=![]() ;保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则Q=
;保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则Q=![]() =K,平衡不移动;
=K,平衡不移动;
II. (3)根据图中信息可知,min时达到平衡状态,v(NH3)=![]() =0.025 mol/(L·min),v(N2)=
=0.025 mol/(L·min),v(N2)=![]() v(NH3)=0.0125 mol/(L·min);反应 N2(g)+3H2(g)
v(NH3)=0.0125 mol/(L·min);反应 N2(g)+3H2(g)![]() 2NH3
2NH3
(5)保持其它条件不变,若只把容器改为恒压容器,加入0.2molN2和0.6molH2,达到平衡时,NH3的体积分数为m%.若向容器中继续加入0.2molN2和0.6molH2,相当于将两份合在一起,体积扩大一倍,各组分的量增加一倍,所以NH3的体积分数为不变,则两者体积分数相等,答案选C。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】(1)2016年9月G20峰会在杭州举行。
①峰会部分场馆使用了新型环保墙面材料硅藻泥。硅藻泥的主要成分SiO2属于______(填字母,下同)。
a. 有机高分子材料 b. 无机非金属材料 c. 金属材料
②峰会场馆空调使用CO2和水作制冷剂。不用氟利昂作制冷剂的目的是______。
a. 防治酸雨 b. 降低温室效应 c. 保护臭氧层
③央行发行了G20峰会金银合金纪念币。关于该纪念币的说法正确的是______。

a. 可以溶于盐酸 b. 相比纯金币,熔点高 c. 相比纯金币,硬度大
(2)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量(每100 g) | 营养成分 | 含量(每100 g) |
水分 | 9.9 g | 钙元素 | 23.00 mg |
脂肪 | 0.2 g | 铁元素 | 1.10 mg |
蛋白质 | 4.8 g | 硒元素 | 0.02 mg |
淀粉 | 82.5 g | 花青素 | 0.10 g |
纤维素 | 2.7 g | 其他 | …… |
①紫薯粉中的脂肪在人体内会水解成高级脂肪酸和_______。
②以上营养成分中_______两种元素是人体中含有的微量元素。
③紫薯中的花青素能消耗活性氧,具有_______性(选填“氧化”或“还原”),可用于抗衰老。
④在酶的作用下,淀粉水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式________。
(3)防治环境污染,呵护生态环境是当今社会的主题之一。
①汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管上加装“催化转化器”使CO、NOx转化为无害物质,下列说法不正确的是_____。
a.CO和NOx反应的化学方程式为:2xCO+2NOx![]() 2xCO2+N2
2xCO2+N2
b.上述方法增加了空气中CO2的含量,加重了酸雨污染
室内装修中使用不合格大理石可能会释放放射性气体________。
②通过水质检测确定水体中污染物的种类和浓度后,可采取不同的方法对污水进行处理。例如向废水中通入臭氧,运用_____(填字母)除去其中含有的油类、氰化物。
a.中和法 b.沉淀法 c.氧化法
废水处理时通常加入明矾作为混凝剂以吸附水中的杂质,明矾水解的离子方程式为________。
③用过的聚乙烯塑料食品袋要回收处理。聚乙烯的结构简式是_______。
④锂电池为动力的新能源汽车可实现汽车低碳排放,锂电池属于_______电池(选填“一次”或“二次”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 在常温下浓硫酸与铁不反应,所以可以用铁制容器来装运浓硫酸
B. 侯氏制碱工业是以氯化钠为主要原料,制得大量NaOH
C. 我国华为AI芯片已跻身于全球AI芯片榜单前列,该芯片的主要材料是二氧化硅
D. 垃圾分类是化废为宝的重要举措,厨余垃圾可用来制沼气或堆肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日光等白光经棱镜折射后产生的是 __________ 光谱。原子光谱则与之不同,它是由不连续特征谱线组成的,称为 ____________ 光谱。根据原子光谱谱线的分析结果,可以得到的信息是原子轨道能量的变化是不连续的,这种情况又称为原子中电子的能量是 ___________ 的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制晶的主要原料。已知多晶硅第三代工业制取流程如图所示:
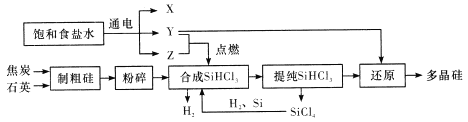
下列说法错误的是
A. Y、Z分别为H2、Cl2
B. 制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1:1
C. SiHCl3极易水解,其完全水解的产物为H2SiO3、H2、HCl,据此推测SiHCl3中硅元素的化合价为+2价
D. Y与SiHCl3制备多晶硅的反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将下列反应的双线桥写出
(1)8H++2NO3﹣+3Cu=Cu 2++2NO↑+4H2O
(2)KClO3+6HCl=KCl+3Cl2↑+3H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中c(H+)最小的是
A.pH=0的溶液B.0.03 mol·L-1H2SO4
C.0.05 mol·L-1HClOD.0.05 mol·L-1的NaHSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将下列反应的双线桥写出
(1)8H++2NO3﹣+3Cu=Cu 2++2NO↑+4H2O
(2)KClO3+6HCl=KCl+3Cl2↑+3H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 含有离子键的化合物一定是离子化合物 B. 离子化合物中不可能含有共价键
C. 含有共价键的化合物一定是共价化合物 D. 共价化合物中可能含有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com