
【题目】据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。下列叙述错误的是
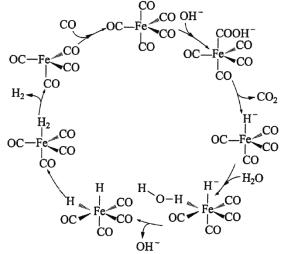
A.OH-参与了该催化循环B.该反应可产生清洁燃料H2
C.该反应可消耗温室气体CO2D.该催化循环中Fe的成键数目发生变化
【答案】C
【解析】
题干中明确指出,铁配合物Fe(CO)5充当催化剂的作用。机理图中,凡是出现在历程中,进去的箭头表示反应物,出来的箭头表示生成物,既有进去又有出来的箭头表示为催化剂或反应条件,其余可以看成为中间物种。由题干中提供的反应机理图可知,铁配合物Fe(CO)5在整个反应历程中成键数目,配体种类等均发生了变化;并且也可以观察出,反应过程中所需的反应物除CO外还需要H2O,最终产物是CO2和H2,同时参与反应的还有OH-,故OH-也可以看成是另一个催化剂或反应条件。
A.从反应机理图中可知,OH-有进入的箭头也有出去的箭头,说明OH-参与了该催化循环,故A项正确;
B.从反应机理图中可知,该反应的反应物为CO和H2O,产物为H2和CO2,Fe(CO)5作为整个反应的催化剂,而OH-仅仅在个别步骤中辅助催化剂完成反应,说明该反应方程式为![]() ,故有清洁燃料H2生成,故 B项正确;
,故有清洁燃料H2生成,故 B项正确;
C.由B项分析可知,该反应不是消耗温室气体CO2,反而是生成了温室气体CO2,故 C项不正确;
D.从反应机理图中可知,Fe的成键数目和成键微粒在该循环过程中均发生了变化,故 D项正确;
答案选C。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:

①将4.4g该有机物完全燃烧,生成 0.2mol CO2和3.6g水;
②用质谱仪测定其相对分子质量,得如图1所示的质谱图;
③A的核磁共振氢谱如图2:
试回答下列问题:
(1)有机物A的相对分子质量是_____________
(2)有机物A的实验式是_____________
(3)有机物A的分子式是_____________
(4)红外光谱上发现A有﹣COOH和2个﹣CH3则有机物A的结构简式 ________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
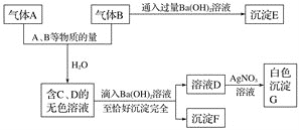
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是你熟悉的物质:
![]() 、金刚石、
、金刚石、 ![]()
![]() 这些物质中,只含离子键的是______
这些物质中,只含离子键的是______
![]() 既含共价键又含离子键的是______
既含共价键又含离子键的是______
![]() 如果将
如果将![]() 溶于水,破坏了
溶于水,破坏了![]() 中化学键的类型为______。
中化学键的类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为_________。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)> I1(Na),原因是_________。I1(Be)> I1(B)> I1(Li),原因是________。
(3)磷酸根离子的空间构型为_______,其中P的价层电子对数为_______、杂化轨道类型为_______。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有____个。
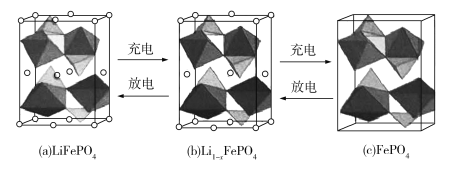
电池充电时,LiFeO4脱出部分Li+,形成Li1xFePO4,结构示意图如(b)所示,则x=_______,n(Fe2+ )∶n(Fe3+)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
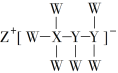
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NH3是工业生产中的常用气体,研究其在工业上的反应过程对提高生产效率尤为重要。
I.工业上用CO和H2做原料可以合成甲醇,作为液体燃料。已知:
① 2H2(g)+CO(g) +![]() O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
(1)请写出用CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:______________。
(2)一定温度下,在容积为2L的恒容容器中加入3mol H2和2mol CO,当反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的
CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的![]() ,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
II.对于氨的合成反应 N2(g)+3H2(g)![]() 2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
(3)恒容条件下,从开始反应到建立起平衡状态,v(N2)=_________;反应达到平衡后,第5分
钟末只改变反应温度,保持其它条件不变,则改变条件后NH3的物质的量浓度不可能为_____。
A. 0.20 mol/L B. 0.12 mol/L C. 0.10 mol/L D. 0.08 mol/L
(4)在第5分钟时将容器的体积缩小一半,反应在第8分钟时达到新的平衡,此时NH3的浓度约为0.30 mol/L。请在上图中画出第5分钟之后的NH3浓度的变化曲线______。
(5)其它条件不变,若只把容器改为恒压容器,加入0.2 molN2和0.6 molH2,达到平衡时,NH3的体积分数为m%。若向容器中继续加入0.2 molN2和0.6 molH2,,在同样的温度下达到平衡时,NH3的体积分数为n%,则m和n的关系正确的是______。
A.m>n B.m<n C.m=n D.无法比较%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.质谱、红外光谱都能够快速、精确地测定有机物的相对分子质量
B.核磁共振氢谱中,CH3COOH、CH3OH都可给出两种峰信号
C.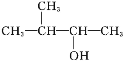 的名称为2-甲基-3-丁醇
的名称为2-甲基-3-丁醇
D.乙二醇和丙三醇互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是某药物的合成中间体,其合成路线如图所示:
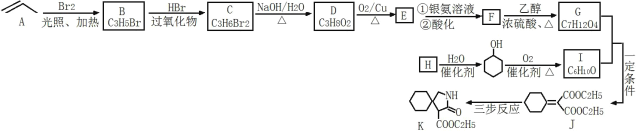
已知:HBr与不对称烯烃加成时,在过氧化物作用下,则卤原子连接到含氢较多的双键碳上;
请回答下列问题:
(1)C的化学名称为____,J中官能团的名称是____;
(2)H→![]() 的原子利用率为100%,则H的结构简式为____;
的原子利用率为100%,则H的结构简式为____;
(3)C→D的化学方程式为____;
(4)E与足量的Ag(NH3)2OH溶液反应的化学方程式为____;
(5)L是G的同分异构体,则满足下列条件的L的结构简式为____(任写一种结构即可)。
①lmol L与足量的NaHCO3溶液反应能生成2molCO2;
②L的核磁共振氢谱有3组峰且峰面积之比为1︰2︰3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com