
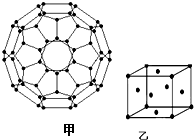
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.分析 (1)28号元素镍,核外有28个电子,根据构造原理写出其基态镍原子的核外电子排布式,根据价电子排布式确定分区;
(2)根据价层电子对互斥理论确定杂化方式,利用均摊法计算每个碳原子含有几个σ键,从而计算1mol C60分子中σ键的数目;
(3)①同一周期元素的第一电离能随着原子序数的增大而增大,但第VA族元素第一电离能大于第VIA元素;
②根据价层电子对互斥理论确定其空间构型;
(4)F的电负性大于N,形成的氢键强度F-H>N-H,因此HF的沸点大于NH3的沸点;NH4F是由NH4+和F-构成的离子化合物,属于离子晶体;N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子;根据均摊法计算晶胞中Cu原子数目,结合相对分子质量及阿伏伽德罗常数表示出晶胞质量,根据晶胞棱长计算晶胞体积,再根据密度计算晶胞质量,据此列方程计算.
解答 解:(1)28号元素镍,核外有28个电子,根据构造原理知其基态镍原子的核外电子排布式的简化形式为[Ar]3d84s2,因此基态镍原子的外围电子排布式为3d84s2,位于周期表d区,
故答案为:3d84s2;d;
(2)每个碳原子含有的σ键个数且不含孤电子对,所以采用sp2 杂化,每个碳原子含有的σ键个数为$\frac{3}{2}$,所以1mol C60分子中σ键的数目=$\frac{3}{2}$×60NA=90NA,
故答案为:sp2;90NA;
(3)①As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,所以第一电离能As>Se,
故答案为:>;
②二氧化硒分子中价层电子对=2+$\frac{1}{2}$(6-2×2)=3,且含有一个孤电子对,所以属于V形,
故答案为:V形;
(4)F的电负性大于N,形成的氢键强度F-H>N-H,因此HF的沸点大于NH3的沸点;NH4F是由NH4+和F-构成的离子化合物,属于离子晶体;
N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
晶胞中含有铜原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为$\frac{4×64}{N{\;}_{A}}$g,该晶胞体积为a3 pm3,则$\frac{4×64}{N{\;}_{A}}$g=a3 pm3×ρ g/cm3,故NA=$\frac{256×1{0}^{30}}{ρ{a}^{3}}$,
故答案为:<;离子;F的电负性大于N,NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键;$\frac{256×1{0}^{30}}{ρ{a}^{3}}$.
点评 本题是对物质结构的考查,涉及核外电子排布式、电离能、分子结构、杂化轨道、配合物、晶胞计算等,难度中等,注意利用均摊法进行晶胞有关计算,理解同周期第一电离能突跃原因.


科目:高中化学 来源: 题型:选择题
| A. | 21.2g | B. | 21.6g | C. | 22.0g | D. | 22.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 需加入的试剂 | 分离装置 | |
| 乙烷(乙烯) | c | D |
| 溴苯(液溴) | b | A |
| 苯(苯酚) | b | A |
| 乙醇(水) | e | C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 H2SO4 溶液是指含有硫酸的质量为9.8 g | |
| B. | 从1L0.5mol•L-1 H2SO4溶液中取出100mL,则取出溶液的物质的量浓度为0.5mol•L-1 | |
| C. | 取0.1mol•L-1H2SO4溶液10mL,加100mL水稀释后,H2SO4的物质的量浓度为0.01mol•L-1 | |
| D. | 150mL 1mol•L-1的NaCl溶液与75mL1mol•L-1的AlCl3溶液Cl-浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.045mol/L | B. | 0.036mol/L | C. | 0.026mol/L | D. | 0.030mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
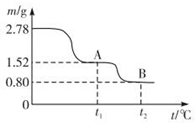 在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中锻烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中锻烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com