
| ||
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.2 mol���� |
| B��0.4 mol���� |
| C��0.2 mol���� |
| D��0.4 mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH=1����Һ�У�Fe2+��NO3-��SO42-��Na+ | ||
| B����ɫ��Һ�У�K+��Fe3+��SO42-��SCN- | ||
C��
| ||
| D����ˮ�����c ��H+��=1��10-14 mol/L����Һ�У�Ca2+��K+��Cl-��HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ʳ�ο�����ζ����Ҳ����ʳƷ������ |
| B������ȼ�ջ�ʯȼ�������������������Ҫ����֮һ |
| C��װ�β����ͷŵļ�ȩ����ɿ�����Ⱦ |
| D��ĥ�����Ĵ��������ʣ�������к��ʱ���˰����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Һ�� | B���ȿ����� |
| C����������ˮ | D���ܸ�ˮ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
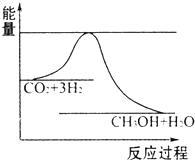 ����Ժ�����¼ұ��ڸ籾���������������ϱ�ʾ���й������ڹ�ҵ���������ٷ�չ�Ĺؼ��Σ���Դ�ṹ��úΪ���������ŷŴ����������ѣ�����ʼ�հ�Ӧ������仯��Ϊ��Ҫս���������ڡ���̼ѭ�����Ѿ������˹�������ӣ��Իش��������⣺
����Ժ�����¼ұ��ڸ籾���������������ϱ�ʾ���й������ڹ�ҵ���������ٷ�չ�Ĺؼ��Σ���Դ�ṹ��úΪ���������ŷŴ����������ѣ�����ʼ�հ�Ӧ������仯��Ϊ��Ҫս���������ڡ���̼ѭ�����Ѿ������˹�������ӣ��Իش��������⣺| 1 |
| 2O2(g) |
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ�� ����ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ʵ�����CH4�ڷ�Ӧ�١�����ת�Ƶ�������ͬ |
| B���ɷ�Ӧ�ٿ���֪��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��l������H��-574kJ/mol |
| C��4NO2��g��+2N2��g��=8NO��g������H=+586kJ/mol |
| D�����ñ�״����4.48L CH4��NO2��ԭΪN2������������ת�Ƶĵ�������Ϊ1.6NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ȡ | B������ |
| C������ | D�������ЧӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1 mol-CH3��1 mol OH-������10 NA������ |
| B�����³�ѹ�£�8gCH4����2NA�����ۼ� |
| C��1L 0.1 mol?L-1�Ĵ�����Һ�к���0.1NA��H+ |
| D����״����22.4 L �Ҵ���̼ԭ����ΪNA |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com