
【题目】关于下列各图的叙述,正确的是( )

A. 根据图甲(S表示溶解度)表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B
B. 图乙表示25℃时,用0.1mol ·L-1盐酸滴定20mL 0.1mol ·L-1NaOH溶液的pH随加入酸体积的变化
C. 根据图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 根据图丁可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
【答案】A
【解析】
A.将A、B饱和溶液分别由t1℃升温至t2℃时两溶液中溶质和溶剂的量都不会改变, 二者t1℃溶解度相同即浓度相同,所以t2℃时溶质的质量分数相等,故A正确;
B.0.1molL-1NaOH溶液的pH为13,用0.1molL-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故B错误;
C.a点所示pH接近12,碱性环境中主要以偏铝酸根离子形式存在,a点溶液中不会大量存在Al3+,故C错误;
D.图丁说明升高温度逆反应速率大于正反应速率,平衡向逆反应方向移动,即正反应是放热反应,△H<0,故D错误;
答案:A


科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。
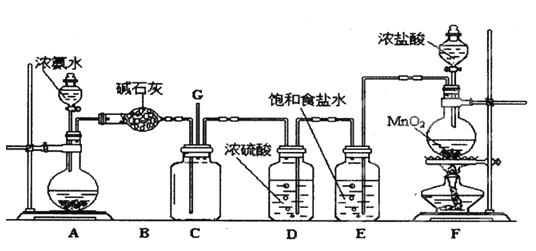
请回答下列问题:
(1)装置F中发生反应的化学方程式为____________________________.
(2)装置B中仪器的名称是___________;装置E的作用是______________________.
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式___________________________________.
(4)装置C内当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为_______mol-1(用含a、b的代数式表示)。
(5)将用F、E、D装置制得的氯气通人含74gCa(OH)2的石灰乳中,最多可制得漂白粉_______g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是
A.2C+SiO2![]() 2CO↑十Si,则每生成4.48 L CO时转移电子0.4NA
2CO↑十Si,则每生成4.48 L CO时转移电子0.4NA
B.1 mol NH3完全溶于水,则n(NH3·H2O)+n(NH4+)=l mol
C.氯化铝在气态时以双聚分子存在,其球棍模型为![]() ,则1 mol双聚分子中含有电子数为128NA
,则1 mol双聚分子中含有电子数为128NA
D.2SO2(g)+O2(g)2SO3(l) △H=-a kJ·mol-1(a>0),则每生成2 mol SO3(l)时吸热a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1000 mol·L-1 NaOH溶液分别滴定0.1000 mol·L-1 HA~HD酸的滴定曲线如图所示。下列说法不正确的是
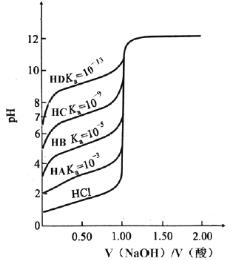
A.等物质的量浓度时,Ka越小滴定突变越不明显,滴定误差越大
B.滴定HC时,滴定终点的pH=7
C.滴定HB时,应该选择酚酞作为指示剂
D.由图像可知在计算HD滴定前溶液pH时不能忽略水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
A. 标准状况下,11.2LCH2Cl2中所含C-Cl键的数目与22.4LHF中所含F原子数目相等
B. 1LpH=13的NaOH溶液中含有OH-的数目一定为0.1NA
C. 1mol过氧化钠分别与足量CO2、SO2反应,转移的电子数均为2NA
D. 10g质量分数为46%的乙醇水溶液中含有的氢原子总数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质中,互为同位素的是___(填序号,下同),互为同系物的是___,互为同分异构体的是____。
①红磷与白磷 ②![]() 与
与![]() ③CH3COOCH3与CH3CH2COOCH3 ④
③CH3COOCH3与CH3CH2COOCH3 ④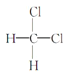 与
与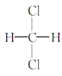 ⑤
⑤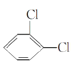 与
与![]() ⑥
⑥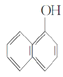 与
与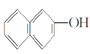 ⑦乙醇与二甲醚
⑦乙醇与二甲醚
(2)按系统命名法给下列有机物命名:
①CH3CH(C2H5)CH(CH3)2:______。
②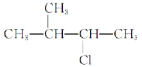 :_____。
:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。请写出反应的离子方程式____________________。Cu放入0.1 mol/L FeCl3溶液中,反应一段时间后取出Cu片,溶液中Fe3+与Fe2+的物质的量浓度之比为4∶3,则反应后溶液中Cu2+与Fe3+的物质的量之比为(______)
A.3∶2 B.3∶8 C.4∶3 D.3∶4
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂。实验室制取氢氧化铁胶体的方法是________(填字母序号)。
A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可
B.在FeCl3溶液中加入足量的NaOH溶液
C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为____________________________________。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:2FeCl3+2KI===2FeCl2+I2+2KI在上式中用双线桥法标出该反应电子转移的方向和数目__________________。向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为 ________色,再将混合液倒入________(填仪器名称)中,将两层液体分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减轻大气污染,必须要加强对工业废气和汽车尾气的治理,根据所学知识回答下列问题:
(1)化石燃料包括煤、石油和________。
(2)酸雨是指pH____(填“>”“<”或“=”)5.6的降水,煤的燃烧是导致酸雨形成的主要原因,而正常雨水的pH约为5.6,原因是__________________ (用化学方程式表示)。
(3)煤的气化是高效、清洁利用煤的重要途径,可将煤炼成焦炭,再将焦炭在高温下与水蒸气反应生成一氧化碳和氢气的化学方程式为_________,该反应的基本类型是_________。
(4)在汽车尾气排放口加装“三效催化净化器”,在不消耗其他物质的情况下,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的气体和无毒的气体,该反应的化学方程式为__________________。
(5)在新能源汽车未普及时,如图所示为一种“节能减排”的有效措施,以下对乙醇作汽车燃料的描述错误的是__________(填字母)。
![]()
A.原料来源丰富 B.是可再生能源 C.燃烧完全没有污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com