
【题目】室温下,用0.1000 mol·L-1 NaOH溶液分别滴定0.1000 mol·L-1 HA~HD酸的滴定曲线如图所示。下列说法不正确的是
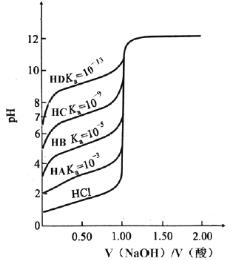
A.等物质的量浓度时,Ka越小滴定突变越不明显,滴定误差越大
B.滴定HC时,滴定终点的pH=7
C.滴定HB时,应该选择酚酞作为指示剂
D.由图像可知在计算HD滴定前溶液pH时不能忽略水的电离
 能力评价系列答案
能力评价系列答案科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰) ![]() Sn(s、白) △H3=+2.1kJ/mol
Sn(s、白) △H3=+2.1kJ/mol
下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
D.灰锡转化为白锡的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为___________________;若只能在加热情况下进行,则反应物A应为_______;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 ,下列说法正确的是
,下列说法正确的是
A.该物质可由两种单体分子之间通过加聚反应生成
B.该物质的有机物单体,不能使FeCl3溶液显紫色
C.0.1 mol单体(有机物)与足量Na反应,生成2.24 L H2(标准状况)
D.1 mol该物质与足量NaOH溶液反应,最多可消耗2n mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代炼铜,主要矿物原料是孔雀石 [Cu2(OH)2CO3],燃料是木炭,涉及的反应有:
①Cu2(OH)2CO3 ![]() 2CuO+CO2↑+H2O②2CuO+C
2CuO+CO2↑+H2O②2CuO+C ![]() 2Cu+CO2↑
2Cu+CO2↑
③CuO+CO ![]() Cu+CO2 ④CO2+C
Cu+CO2 ④CO2+C ![]() 2CO
2CO
(1)从四种基本反应类型看:反应①、②、④分别属于:______、________、____________。
(2)在上述反应中,属于氧化还原反应的是 __________________(填序号)。其中这几个反应的氧化剂分别是:____________、___________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是( )

A. 根据图甲(S表示溶解度)表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B
B. 图乙表示25℃时,用0.1mol ·L-1盐酸滴定20mL 0.1mol ·L-1NaOH溶液的pH随加入酸体积的变化
C. 根据图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 根据图丁可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)在催化剂存在的条件下,用H2将NO还原为N2。已知:
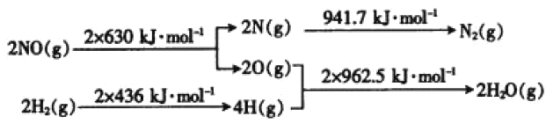
则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_____。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g)在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
①反应进行到4min时,v(正)__v(逆) (填“>”“<”或“=”)。0~4min,H2的平均反应速率v(H2)=_mol·L-1·min-1。
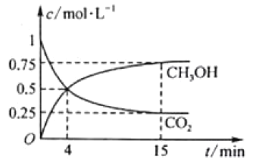
②CO2平衡时的体积分数为___,该温度下Kp为__(用含有p0的式子表示)。
③下列能说明该反应已达到平衡状态的是___。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1mol CO2,3mol H2 | 0.5mol CO2,1mol H2 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol ·L-1 | C1 | C2 |
则乙容器中反应起始向___方向进行;c1___c2。(填“>”“<”或“=”)
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】外循环三相反应器连续制备高锰酸钾新技术是目前高锰酸钾工业发展的主要方向。该法以软锰矿(主要成分为MnO2)为原料生产高锰酸钾。该工艺路线制备高锰酸钾如下:

![]()
已知:一些化合物溶解度(单位:g)随温度的变化如表
温度℃ | KMnO4 | KCl | K2CO3 |
20 | 6.4 | 34.0 | 52.5 |
90 | 45.2 | 56.7 | 60.9 |
回答下列问题:
(1)原料软锰矿与氢氧化钾按一定的比例在“进料”时加热熔融后再和氧气进行“反应”,“进料”前应将软锰矿粉碎,其作用是____。
(2)“反应”中发生反应的化学方程式为____。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即向溶液中通入CO2气体,使体系呈中性或弱碱性。
K2MnO4发生歧化反应时,能否用盐酸代替CO2____(请填写“能”或“不能”)。待锰酸钾全部歧化后,静置一段时间后过滤。从滤液中得到高锰酸钾晶体的操作是:____。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为____,电解产物____可以循环利用。
③“CO2歧化法”和“电解法”相比较,K2MnO4的理论利用率之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是电镀镍和化学镀镍时使用的主要镍盐。以废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍晶体的流程如图所示:
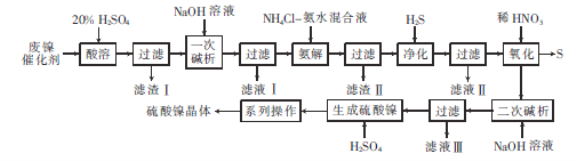
已知:Ni3+的氧化性比稀HNO3强。
回答下列问题:
(1)已知:Cr3++4OH-= CrO2-+2H2O。“一次碱析”时,需加入过量的NaOH溶液的目的是______________________。
(2)“氨解”的目的为_______________________。
(3)“净化”“过滤”后得到含有两种元素的不溶性化合物,该化合物的化学式为________,写出“氧化”中发生反应的离子方程式:____________________________________。
(4)从NiSO4溶液中得到硫酸镍晶体需经过“系列操作”为__________,__________,过滤,洗涤,干燥(填操作名称)。
(5)1844年,科学家发现金属镍可以用NaH2PO2将水溶液中的Ni2+还原出来,NaH2PO2将转化为H3PO3,这一原理现用于化学镀镍。写出化学镀镍原理的离子方程式___________。
(6)为测定硫酸镍晶体(NiSO4·n H2O)的组成,进行如下实验:称取2.63g样品,配成250.00mL溶液,准确量取配制的溶液25.00mL,用0.0400mol/L EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL。则硫酸镍晶体的化学式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com