
设NA 表示阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,0. 1 mol Cl2 溶于水,转移的电子数目为0. 1NA
B.常温常压下,18 g H2O 中含有的原子总数为3NA
C.标准状况下,11. 2 L CH3CH2OH 中含有的分子数目为0. 5NA
D.常温常压下,2. 24 L CO 和CO2 混合气体中含有的碳原子数目为0. 1NA
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
某炼铁废渣中含有大量的CuS及少量铁的氧化物,工业上以该废渣和NaCl为原料生产CuCl2·2H2O晶体,其工艺流程中主要涉及焙烧、尾气处理、酸浸、调控溶液pH、过滤、蒸发结晶等。焙烧过程中发生的主要反应为:CuS+2NaCl+2O2 = CuCl2+Na2SO4
请回答下列问题:
(1)若最后所得的滤液中的阴离子只有SO42—和Cl—,检验滤液中这两种离子的实验操作为: ______
。
(2)焙烧时还有废气SO2产生,若在实验室中以碱液吸收处理之,下列A、B、C装置中可行的是________ (填字母);若选用甲装置,则烧杯中的下层液体可以是_______ 。
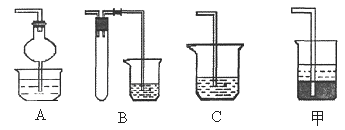 |
(3)回收SO2既能减少大气污染,又能充分利用资源。
①已知用Fe2+、Fe3+作催化剂,一定条件下在催化转化器中SO2能被O2氧化成SO42-,其中写以Fe3+为催化剂时的反应过程:
;4H++O2+4 Fe2+ === 4 Fe3+ + 2H2O
②目前国际上最先进的海水脱硫技术可对电厂尾气进行处理。这一技术的基本原理是:利用海水显弱碱性的特点,将含二氧化硫的尾气与海水、空气充分混和,最终使二氧化硫转换为硫酸盐并且不污染海水。流程图如下:
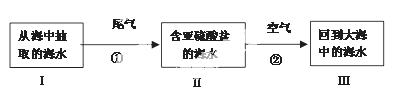
若海水I中主要阴离子为HCO3-,则反应①的离子方程式为 ;
反应②的离子方程式为 ;
检验海水Ⅲ中是否含有SO32- 所用的试剂为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.已知:
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g•cm﹣3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
以下为某兴趣小组模拟从紫菜提取碘单质的过程:
紫菜→(焙烧)→(浸取) (操作①)
(操作①) (操作②)→(蒸馏)→粗产品
(操作②)→(蒸馏)→粗产品
(1)实验室中焙烧紫菜用到的仪器有 CEF .
A.烧杯 B.蒸发皿 C.坩埚 D.试管 E.酒精灯 F.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式 2I﹣+H2O2+2H+═I2+2H2O .
(3)操作①的名称是 过滤 ;试剂A为 四氯化碳 (填本题表格中一种最佳化学试剂的名称),不使用另外两种试剂的主要原因分别是:
Ⅰ 乙醇与水互溶 ;
Ⅱ 裂化汽油能与碘发生加成反应 .
(4)操作②应在 分液漏斗 (仪器名称)中振荡、静置,操作时先分离出的是 下层液体 .
(5)将下列装置图中缺少的必要仪器补画出来以最终将单质碘与试剂A分离:
查看答案和解析>>
科目:高中化学 来源: 题型:
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:□Al+□NaNO3+□NaOH===□NaAlO2+□N2↑+□H2O。若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol•L-1FeCl2溶液:H+、Na+、Cl-、NO3-
B.c(OH-)=0.1 mol•L-1的溶液:K+、Na+、ClO-、NO3-
C.c(H+)=0.1 mol•L-1的溶液:K+、Na+、HCO3-、SO42-
D.与铝反应产生大量氢气的溶液:Ba2+、Na+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
下列叙述正确的是( )
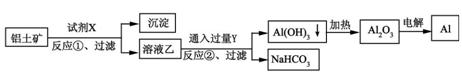
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2 + CO2 + 2H2O=Al(OH)3↓ + NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
⑴烟气脱硫、脱硝的环境意义是 。
⑵选择性催化还原法的脱硝原理为:6NOx+4x NH3 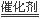 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为 L。
②已知:2H2(g)+O2(g) =2H2O (g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH= 。
⑶目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
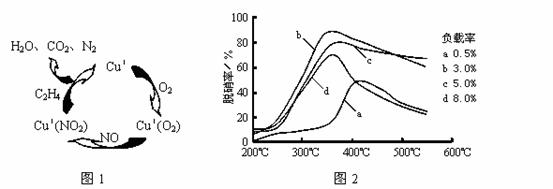
①写出该脱硝原理总反应的化学方程式: 。
②为达到最佳脱硝效果,应采取的条件是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。
下列说法错误的是
A.反应CO(g)+H2O(g) CO2(g)+H2(g)的△H>0
CO2(g)+H2(g)的△H>0
B.在T2时,若反应进行到状态D,则一定有v正<v逆
C.平衡状态A与C相比,平衡状态A的c(CO)小
D.若T1、T2时的平衡常数分别为K1、K2,则K1< K2
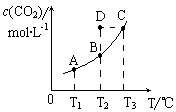
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中所含的杂质(括号内为杂质),选用试剂正确的是( )
A.Al2O3(SiO2):NaOH溶液
B.CO2(SO2):Na2CO3溶液
C.FeCl2溶液(FeCl3):Fe粉
D.NaHCO3溶液(Na2CO3溶液):Ca(OH)2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com