
【题目】用铝箔包裹0.1mol金属钠,用针在铝箔上扎一些小孔,用镊子夹住,放入水中,待完全反应后,收集到的气体在标准状况下的体积为
A. 等于1.12L B. 等于0.56L C. 大于1.12L D. 小于1.12L
科目:高中化学 来源: 题型:
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是________。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:(熔点:SO2 -76.1 ℃,SO3 16.8 ℃;沸点:SO2 -10 ℃,SO3 45 ℃)
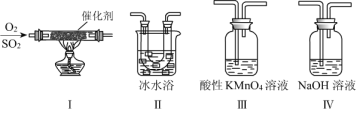
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是__________________。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是_____________________;装置Ⅳ的作用是_________________。
③装置Ⅲ中溶液逐渐褪色,说明SO2具有__________性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 甲苯既可使溴的CCl4溶液褪色,也可使KMnO4酸性溶液褪色
B. 有机物![]() 的消去产物有2种
的消去产物有2种
C. 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2===CH—COOCH3
D. 可用溴水鉴别直馏汽油、四氯化碳和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A. 苯与氢气反应生成环己烷 B. 甲烷与氯气反应生成一氯甲烷
C. 乙醇与氧气反应生成乙醛 D. 乙烯与溴反应生成1,2-二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。根据掌握的知识判断,下列有关实验操作的描述正确的是________(填下列各项序号)。
A.从试剂瓶中取出的任何药品,若有剩余均不能再放回原试剂瓶中
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.配制硫酸溶液时,可先在量筒中加入一定体积的水,再慢慢加入浓硫酸并不断搅拌
D.各放一张质量相同的滤纸于托盘天平的两托盘上,将NaOH固体放在左盘纸上称量
E.NaOH溶液不能保存在带有玻璃塞的试剂瓶中
F.将用水润湿的pH试纸浸入稀盐酸中,测定溶液的pH
(2)化学实验中,不正确的操作会对实验结果的准确性造成一定的影响,请用“>”、“<”或“=”填写下列空白:
①用托盘天平称取10.4 g氯化钠,若将砝码和氯化钠的位置放颠倒了,所称取的氯化钠的质量________10.4 g。
②用容量瓶配制500 mL 0.1 mol·L-1NaOH溶液,定容时仰视刻度线,所得溶液的物质的量浓度________0.1 mol·L-1。
(3)实验时为使氯气、氨气在如图所示装置中充分混合并反应,在a口通入的气体是_______,若氨气量较多,则瓶内会出现大量白烟,该白烟为___________,反应的方程式为___________(已知氮元素被氧化生成常见的单质)。
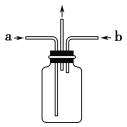
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年12月12日,中国矿业报报道中国地质科学院矿产综合利用研究所认定石龙铜矿含铜品位高(含铜3.27%)。已知铜矿物以黄铜矿、斑铜矿和辉铜矿为主。黄铜矿(CuFeS2)既是制取铜及其化合物的主要原料,又可以制备硫及铁的化合物。请回答下列问题:
(1)冶炼铜的反应方程式为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2↑,若CuFeS2中铁元素为+2价,则反应中被还原的元素为________(填元素名称)。
8Cu+4FeO+2Fe2O3+16SO2↑,若CuFeS2中铁元素为+2价,则反应中被还原的元素为________(填元素名称)。
(2)上述冶炼过程中产生大量二氧化硫,下列对其性质的描述中正确的是________(填序号)。
A.SO2既是氧化剂,又是还原剂
B.SO2是还原产物
C.SO2是形成酸雨的一种物质
D.SO2是氧化产物
(3)SO2的存在对CO2的检验会造成干扰,实验室常用酸性高锰酸钾溶液除去SO2,请写出该反应的化学方程式:________________________________。
(4)利用黄铜矿冶炼产生的炉渣(含FeO、Fe2O3、SiO2、Al2O3)可制备Fe2O3。方法为先用稀盐酸浸取炉渣,过滤;将滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。用下列哪些试剂可以验证炉渣中含有FeO?________________(填序号)其中发生氧化还原反应的离子方程式为____________________。
A.稀盐酸 B.稀硫酸 C.KSCN溶液 D.KMnO4溶液 E.NaOH溶液 F.碘水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热7.78g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g。
(1)原混合物中碳酸氢钠的质量为______,反应的化学方程式为 ______________。
(2)将剩余固体溶于水,配成500mL溶液,所得溶液的物质的量浓度为______。取出该溶液50mL,向其中逐滴滴入0.2mol/L盐酸35mL,完全反应后在标准状况下生成二氧化碳的体积为_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com