
【题目】2013年12月12日,中国矿业报报道中国地质科学院矿产综合利用研究所认定石龙铜矿含铜品位高(含铜3.27%)。已知铜矿物以黄铜矿、斑铜矿和辉铜矿为主。黄铜矿(CuFeS2)既是制取铜及其化合物的主要原料,又可以制备硫及铁的化合物。请回答下列问题:
(1)冶炼铜的反应方程式为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2↑,若CuFeS2中铁元素为+2价,则反应中被还原的元素为________(填元素名称)。
8Cu+4FeO+2Fe2O3+16SO2↑,若CuFeS2中铁元素为+2价,则反应中被还原的元素为________(填元素名称)。
(2)上述冶炼过程中产生大量二氧化硫,下列对其性质的描述中正确的是________(填序号)。
A.SO2既是氧化剂,又是还原剂
B.SO2是还原产物
C.SO2是形成酸雨的一种物质
D.SO2是氧化产物
(3)SO2的存在对CO2的检验会造成干扰,实验室常用酸性高锰酸钾溶液除去SO2,请写出该反应的化学方程式:________________________________。
(4)利用黄铜矿冶炼产生的炉渣(含FeO、Fe2O3、SiO2、Al2O3)可制备Fe2O3。方法为先用稀盐酸浸取炉渣,过滤;将滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。用下列哪些试剂可以验证炉渣中含有FeO?________________(填序号)其中发生氧化还原反应的离子方程式为____________________。
A.稀盐酸 B.稀硫酸 C.KSCN溶液 D.KMnO4溶液 E.NaOH溶液 F.碘水
【答案】铜元素、氧元素 CD 5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4 BD 5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
【解析】
(1)得到电子化合价降低的元素被还原;
(2)根据二氧化硫的性质以及反应中硫元素的化合价变化分析解答;
(3)根据氧化还原反应中电子得失守恒以及原子守恒书写方程式;
(4)根据氧化亚铁中铁元素的化合价是+2价易被氧化分析解答。
(1)若CuFeS2中铁元素为+2价,则铜元素是+2价,硫元素是-2价。根据方程式可知反应后铜元素和氧元素化合价降低,所以反应中被还原的元素为铜元素和氧元素。
(2)A.反应中硫元素化合价升高,被氧化,所以SO2是氧化产物,A错误;
B.SO2是氧化产物,B错误;
C.SO2溶于水生成亚硫酸,亚硫酸被氧化生成硫酸,因此二氧化硫是形成酸雨的一种物质,C正确;
D.SO2是氧化产物,D正确;
答案选CD;
(3)SO2被酸性高锰酸钾溶液氧化生成硫酸,高锰酸钾被还原为锰离子,反应中硫元素化合价从+4价升高到+6价,失去2个电子,锰元素化合价从+7价降低到+2价,得到5个电子,因此根据电子得失守恒以及原子守恒可知该反应的化学方程式为5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4;
(4)FeO中铁元素是+2价,可溶于酸生成亚铁离子,亚铁离子能使酸性高锰酸钾溶液褪色,由于盐酸也能被高锰酸钾溶液氧化,所以选择稀硫酸对炉渣进行浸取,答案选BD,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
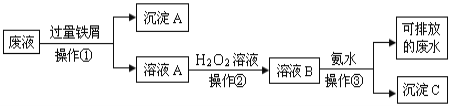
(1)操作①的名称是_______。
(2)沉淀A中含有的金属单质有_______。
(3)操作②中观察到的实验现象是_______。
(4)操作③中发生反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述不正确的是
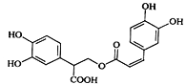
A. 迷迭香酸不属于芳香烃
B. 1mol迷迭香酸最多能和含6mol Br2的浓溴水反应
C. 迷迭香酸可以发生水解反应、取代反应和酯化反应
D. 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铝箔包裹0.1mol金属钠,用针在铝箔上扎一些小孔,用镊子夹住,放入水中,待完全反应后,收集到的气体在标准状况下的体积为
A. 等于1.12L B. 等于0.56L C. 大于1.12L D. 小于1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·新课标全国卷Ⅰ) 秸秆(含多糖类物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:
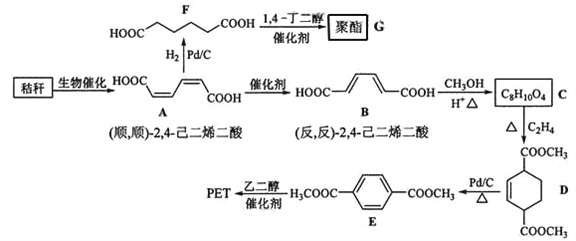
回答下列问题:
(1)下列关于糖类的说法正确的是______________。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为______。
(3)D中官能团名称为______,D生成E的反应类型为______。
(4)F 的化学名称是______,由F生成G的化学方程式为______。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成44 g CO2,W共有______种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为_________。
(6)参照上述合成路线,以(反,反)2,4己二烯和C2H4为原料(无机试剂任选),设计制备对二苯二甲酸的合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(分子式为C13H18O2)是一种香料,下图是该香料的一种合成路线。
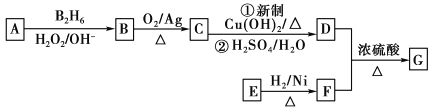
已知:
①E能够发生银镜反应,1 mol E能够与2 mol H2完全反应生成F
②R—CH=CH2![]() R—CH2CH2OH
R—CH2CH2OH
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链
回答下列问题:
(1)用系统命名法命名有机物B:__________。
(2)E的结构简式为__________。
(3)C与新制Cu(OH)2反应的化学方程式为______________________________________________。
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为__________________
(5)已知有机物甲符合下列条件:①为芳香族化合物②与F互为同分异构体③能被催化氧化成醛。
符合上述条件的有机物甲有_________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积之比为6∶2∶2∶1∶1的有机物的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题: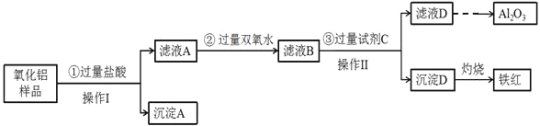
(1)操作I的名称是_________;写出沉淀A和烧碱溶液反应的化学方程式__________。
(2)滤液A中加入过量双氧水的目的是___________;验证滤液A中存在Fe3+的具体操作和现象为:_________________。
(3)滤液D焰色反应呈黄色,试剂C是_________(填化学式);步骤③中铝元素转化的离子方程式为 _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
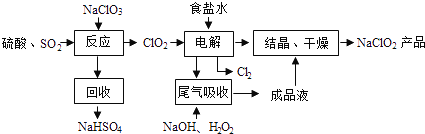
回答下列问题:
(1)NaClO2中Cl的化合价为__________价。
(2)写出“反应”步骤中生成ClO2的化学方程式___________________。
(3)“电解”中阴极反应的主要产物是_________________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应中,氧化剂与还原剂的物质的量之比为_________, 该反应中氧化产物是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X可作为合成青蒿素的一种基本原料,已知X的结构如下,下列有关X的说法正确的是
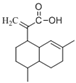 ( )
( )
A. X为烃的含氧衍生物
B. X最多可以和3mol H2发生加成反应
C. X只能发生取代反应和加成反应
D. X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com