
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是
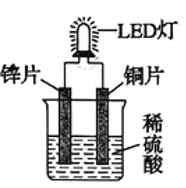
A.铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B.如果将锌片换成铁片,电路中的电流方向将改变
C.其能量转化的形式主要是“化学能→电能→光能”
D.如果将稀硫酸换成蔗糖容液,LED灯将会发光
【答案】C
【解析】
根据电池两极材料以及电解质溶液的溶质可知,该电池的总反应为Zn+H2SO4=ZnSO4+H2↑,所以锌片发生氧化反应为电池的负极,铜片上氢离子发生还原反应为电池的正极。
A.铜片作正极,电极上氢离子发生还原反应生成氢气,有气泡产生,溶液中没有Cu2+产生,故A错误;
B.如果将锌片换成铁片,电池总反应为铁与稀硫酸的反应,铁作正极,铜依然为负极,电路中的电流方向不会发生改变,故B错误;
C.原电池的能量变化为化学能→电能,LED灯工作时能量变化为电能→光能,故C正确;
D.蔗糖为非电解质,蔗糖溶液不导电,改换蔗糖溶液后无法形成闭合回路,无法形成原电池,故D错误;
综上所述,故答案为C。


科目:高中化学 来源: 题型:
【题目】根据下表给出的几种物质的熔沸点数据,判断下列说法中错误的是
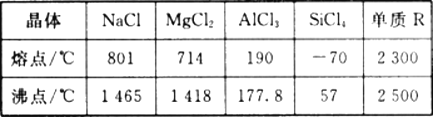
A. SiCl4 和A1Cl3都是分子晶体 ,熔融状态下不导电
B. MgCl2和NaCl都是离子晶体,熔融状态能导电且易溶于水
C. 若单质R是原子晶体,其熔沸点的高低是由共价键的键能决定的
D. 固态时可导电的一定是金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物是中学化学中常见的物质。
(1)铁件表面镀铜可有效防止铁被腐蚀,电镀时,以CuSO4溶液为电解液,铜作________(填 “阳”或“阴”)极,铜离子向________极移动,阴极的电极反应式为________。
(2)常温时,FeCl3溶液pH<7,原因是(用离子方程式表示)________。
(3)将0.1mol·L-1 FeCl3溶液滴加到Mg(OH)2悬浊液中,有红褐色沉淀产生。该变化的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() C(g)+nD(g),开始时A为4mol,B为6mol,5min末反应达到化学平衡,此时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol·L-1·min-1。计算:
C(g)+nD(g),开始时A为4mol,B为6mol,5min末反应达到化学平衡,此时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol·L-1·min-1。计算:
(1)平衡时A的物质的量浓度为___。
(2)前5min内用B表示的化学反应速率v(B)为___。
(3)化学方程式中n值为___。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol·L-1·min-1②v(B)=6mol·L-1·min-1③v(C)=0.075mol·L-1·s-1④v(D)=0.1mol·L-1·s-1
其中反应速率最快的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
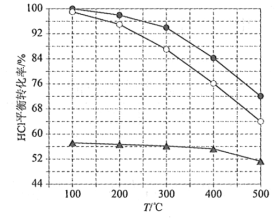
可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
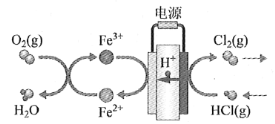
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,通过碘循环系统可以吸收工业废气中的SO2制备一种重要的化工原料M,同时完成氢能源再生(如图所示)。下列说法错误的是( )
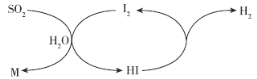
A.开发氢能源有利于社会可持续发展
B.为提高SO2的吸收效率,应不断分离出HI
C.I2为整个循环过程的催化剂
D.M为硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,用相应的化学用语回答下列问题;
① | |||||||
② | ③ | ④ | ⑤ | ||||
⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中用序号标出的10种元素中,非金属性最强元素的离子结构示意图是____________。
(2)④、⑦、⑩的离子半径由大到小的顺序为____________(用元素符号作答)。
(3)由表中④、⑥元素可以组成一种淡黄色的物质,画出该物质的电子式____________,该物质含有的化学键类型有____________。
(4)元素②的简单气态氢化物为X,0.1molX完成燃烧生成稳定氧化物时放出akJ的能量,写出X燃烧热的热化学方程式:____________。
(5)写出实验室制备氨气的反应方程式____________。
(6)一种氢气燃料电池的原理如图:
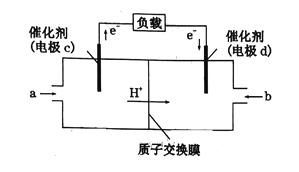
a极通入的气体是____________,正极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质:
①![]() 和
和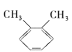 ②D和T ③甲烷(CH4)与丙烷(C3H8) ④O2与O3 ⑤H2O和H2O2 ⑥
②D和T ③甲烷(CH4)与丙烷(C3H8) ④O2与O3 ⑤H2O和H2O2 ⑥![]() 和
和![]()
(1)互为同位素的是______________(填序号,下同)。
(2)互为同素异形体的是________________。
(3)互为同分异构体的是________________。
(4)属于同一种物质的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示,(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是( )
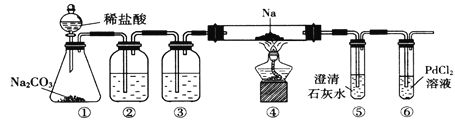
A. 装置①的仪器还可以制取H2气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com