
【题目】将14.2g Na2SO4完全溶于水中,配成500 mL溶液,其物质的量浓度为__________;若从中取出50 mL,Na+物质的量浓度为___________;若将这50 mL溶液用水稀释至100 mL,所得溶液中SO42-的物质的量浓度为___________。
科目:高中化学 来源: 题型:
【题目】丁二酮肟(![]() )是检验Ni2+的灵敏试剂。
)是检验Ni2+的灵敏试剂。
(1)Ni2+基态核外电子排布式为________。丁二酮肟分子中C原子轨道杂化类型为________,1 mol丁二酮肟分子所含σ键的数目为________,分子中各原子的电负性由大到小的顺序为________________。
(2)Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点-19.3 ℃,沸点42.1 ℃,易溶于有机溶剂。
①Ni(CO)4固态时属于________晶体(填晶体类型)。
②与CO互为等电子体的阴离子为____________(填化学式)。
(3)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为_________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4②甲基红4.4~6.2③酚酞8.2~10.0,现用0.1000mol·L-1的NaOH溶液滴定浓度相近的乙酸时,上述指示剂( )
A.都可以用B.只能用③C.可以用①或②D.可以用②或③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型髙效絮凝剂,在医药上也可于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的流程如下:
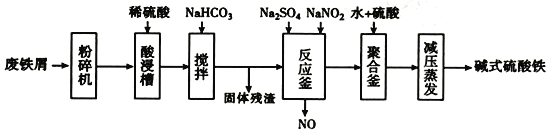
已知:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
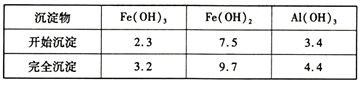
回答下列问题:
(1)粉碎过筛的目的是____________________。
(2)加入少量NaHCO3的目的是________。
(3)反应釜中发生反应的离子方程式为_______________________。在实际生产中,常同时通入02以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为________。
(4)聚合釜中溶液的PH必须控制在一定的范围内。PH偏小时Fe3+水解程度弱,PH偏大时则_____________________________________。
(5)采取减压蒸发的原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机物X、Y均为重要的工业原料,可由A和环己烯(![]() )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):

已知:ⅰ.X的结构简式是: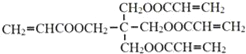
ⅱ.![]()
ⅲ.![]()
(1)X的化学式是____,A中含氧官能团的名称是_____;第①步反应的类型是___。
(2)下列有关说法正确的是_______。
a.H与苯酚可以用FeCl3溶液区分
b.G、H分别经一步反应都可得到环己烯
c.D的所有同分异构体在红外光谱仪中显示的信号(或数据)完全相同
d.试剂a是浓硫酸
e.反应②加高锰酸钾可以实现
(3)Y的结构简式是_____________________________________。
(4)已知1mo1W与1mol H2经加成反应生成1molE,写出W的同分异构体能同时满足下列条件的结构简式是_________________________________。
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生水解反应
③核磁共振氢谱显示为3组峰,且峰面积比为6:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72 L CH4 ②3.01×1023个HCl ③13.6 g H2S ④0.2 mol NH3,下列对四种气体的关系表示不正确的是
A. 体积④<①<③<② B. 密度①<④<③<②
C. 质量④<①<③<② D. 氢原子数④<②<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)银作为催化剂,主要用于乙烯氧化制环氧乙烷、甲醇氧化制甲醛等。目前银催化剂的市场需求呈逐年增加的趋势。请写出甲醇在银催化下制备甲醛的化学方程式
________________________________________________________________。
(2)银催化剂在使用过程中,催化活性逐渐减弱、选择性降低,一定时间后必须更换。某工厂对失效银催化剂进行回收并实现再生,工艺流程如下:

已知:银催化剂主要成分(X射线荧光光谱法分析)
元素 | Al2O3 | Ag | MgO | SiO2 | K2O | Fe2O3 |
含量% | 82 | 14.8 | 1.4 | 0.9 | 0.5 | 0.1 |
资料:经X射线衍射仪检测,其中氧化铝的晶型为α型,难于酸。
①操作a和操作b的名称是_________。
②请写出过程Ⅰ中银与稀硝酸反应的离子方程式
________________________________________________________________。
(3)滤液2 中含有多种金属离子,请简述检验其中K+的实验方法
____________________________________________________________________。
(4)结合化学用语从平衡移动角度解释过程Ⅲ中用氨水将氯化银沉淀溶解的原
因_______________________________________________________________。
(5)过程Ⅳ采用肼(N2H4)作为还原剂,具有不混入金属杂质、还原性强、得到银纯度高等优点,该过程的化学方程式为:
________________________________________________________。
(6)利用过程Ⅴ实现银催化剂再生,其简易装置图如下:

写出催化剂再生的电极反应式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
(1)操作①的名称是_________。
(2)试剂a是_________,试剂b 是_________ 。
(3)加入试剂a所发生反应的离子方程式为_________。
加入试剂b所发生反应的离子方程式为_________。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进? _____(若能,此问不用回答).
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外。至少还要获得的数据是_________的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com