
【题目】下列叙述中通常不能作为判断两元素非金属性强弱的依据是( )
A.气态氢化物稳定性强弱B.元素氧化性强弱
C.最高价氧化物对应水化物的酸性强弱D.单质熔点高低
科目:高中化学 来源: 题型:
【题目】已知:CH3﹣CH═CH2+HBr﹣→CH3﹣CHBr﹣CH3(主要产物).1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化. 
(1)A的化学式: , A的结构简式: .
(2)上述反应中,①是反应,⑦是反应.(填反应类型)
(3)写出C、D、E、H物质的结构简式: C , D , E , H .
(4)写出D﹣→F反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。回答下列问题:

(1)写出各物质的化学式:A.___,B.___,C.____,D.____,E.____。
(2)写出B→C、D→E反应的离子方程式:
B→C:____________________________________________________________;
D→E:____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制物质的量浓度均为0.2 molL-1的NaOH溶液和稀H2SO4各500mL。
提供的试剂是:NaOH固体和98%的浓H2SO4(密度为1.84 g/cm3)及蒸馏水。
(1)应用托盘天平称量NaOH__________g,应用10mL量筒量取浓H2SO4____________mL。
(2)配制两种溶液时都需要的仪器是__________。
(3)在配制上述溶液实验中,下列操作引起结果偏低的有_________________(填序号)
A、在烧杯中溶解溶质搅拌时,溅出少量溶液
B、没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中
C、定容时,仰视容量瓶刻度线以控制加水量
D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E、将浓硫酸在烧杯中稀释后,趁热转移进容量瓶进行后续配置步骤
F、容量瓶刚用蒸馏水洗净,没有烘干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关实验寧实的说明或解释正确的是
A. 用坩埚钳夹住一小块用砂纸打磨过的铝箔在洒精灯上加热,铝熔化但不滴落,说明Al2O3的熔点高于Al
B. 向某溶液中先淌加Ba(NO3)2溶液,出现白色沉淀,再滴加稀硝酸,沉淀不溶解,说明原溶液中一定含有SO42-
C. 向新制氯水中加入少量NaHCO3固体,出现较多气体,说明HClO的酸性强于H2CO3
D. 向某溶液中先滴加KSCN溶液,溶液不变红,再滴加双氧水,溶液变红,说明原溶液中一定含有Fe2+
【答案】AD
【解析】A、加热打磨过后的铝箔,铝表面生成氧化铝薄膜,铝熔化说明铝熔点低,但铝不滴落,说明氧化铝熔点非常高,故A正确;B、溶液中也可能存在的SO32-,Ba2+与SO32-反应生成白色的BaSO3沉淀,SO32-有强还原性,再加硝酸,硝酸将BaSO3氧化为不溶于硝酸的BaSO4,所以无法判断原溶液中是否含有SO42-,故B错误;C、氯气与水反应生成盐酸和次氯酸,加入NaHCO3固体,产生CO2,只能说明氯水酸性强于H2CO3,并不能说明HClO酸性强于碳酸,故C错误;D、向溶液中先滴加KSCN溶液,溶液不变红,则证明溶液中不含Fe3+,再加双氧水,溶液变红,说明原溶液中一定含有Fe2+被双氧水氧化为Fe3+,故D正确。故选AD。
【题型】多选题
【结束】
21
【题目】某种制取纯碱的方法如下:
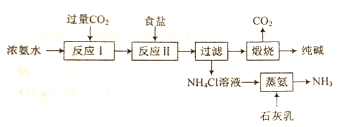
(1)写出“反应I ”的化学方程式:__。
(2)“反应Ⅱ”为复分解反应,反应中所涉及物质的溶解度如图所示。写出“反应Ⅱ”的化学方程式:__。

(3)写出“煅烧”反应的化学方程式:__。
(4) “蒸氨”时需要加热,写出“蒸氨”时反应的化学方程式:___。
(5)写出将“蒸氨”产生的氨气通入Al2(SO4)3溶液中时反应的离子方程式: __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应:Z(?)+W(?)X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( ) 
A.Z和W在该条件下至少有一个是为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等
C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和浓硫酸发生反应的化学方程式为:Cu +2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生__________反应;浓H2SO4作_______剂,具有___________性。在该反应中,若消耗了32gCu,则转移了_______mol 电子 。
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生__________反应;浓H2SO4作_______剂,具有___________性。在该反应中,若消耗了32gCu,则转移了_______mol 电子 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A. 标准状况下,反应过程中得到6.72L的气体
B. 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C. 最终得到7.8g的沉淀
D. 最终得到的溶液中c(Na+)=1.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铝合金投入100mL一定物质的量浓度盐酸中,合金全部溶解,向所得溶液中滴加4mol /LNaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如图(横坐标体积单位是mL,纵坐标质量单位是g),求:

(1)原合金中Mg、Al质量各多少克?_________
(2)盐酸的物质的量浓度c(HCl)=____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com