
����Ŀ��ʵ�����������ʵ���Ũ�Ⱦ�Ϊ0.2 molL-1��NaOH��Һ��ϡH2SO4��500mL��
�ṩ���Լ��ǣ�NaOH�����98%��ŨH2SO4���ܶ�Ϊ1.84 g/cm3��������ˮ��
��1��Ӧ��������ƽ����NaOH__________g��Ӧ��10mL��Ͳ��ȡŨH2SO4____________mL��
��2������������Һʱ����Ҫ��������__________��
��3��������������Һʵ���У����в���������ƫ�͵���_________________������ţ�
A�����ձ����ܽ����ʽ���ʱ������������Һ
B��û��������ˮϴ�ձ�2��3�Σ�����ϴҺ��������ƿ��
C������ʱ����������ƿ�̶����Կ��Ƽ�ˮ��
D����������Һ������ƿת�Ƶ��Լ�ƿʱ������������
E����Ũ�������ձ���ϡ�ͺ���ת�ƽ�����ƿ���к������ò���
F������ƿ��������ˮϴ����û�к��
���𰸡� 4.0 5.4 �������ձ�����ͷ�ιܡ�500ml����ƿ ABC
����������1��n(NaOH)= n(H2SO4)=cV=0.2mol/L��0.5L=0.1mol��m(NaOH)=nM=0.1mol��40g/mol=4.0g��
98%��ŨH2SO4���ܶ�Ϊ1.84 g/cm3��cŨ=![]() mol/L=18.4mol/L��
mol/L=18.4mol/L��
����n(H2SO4)=cŨ��VŨ=cϡ��Vϡ=0.1mol����Ҫ��ȡŨ����VŨ=![]() =0.0054L=5.4mL���ʴ�Ϊ��4.0��5.4��
=0.0054L=5.4mL���ʴ�Ϊ��4.0��5.4��
��2������NaOH��Һ�IJ����Ǽ��㡢�������ܽ⡢ϴ�ӡ����ݡ�ҡ�ȡ�װƿ���õ��������ǣ�������ƽ���ձ�����������500ml����ƿ����ͷ�ιܣ�����ϡH2SO4�IJ����Ǽ��㡢��ȡ��ϡ�͡�ϴ�ӡ����ݡ�ҡ�ȡ�װƿ���õ��������ǣ���Ͳ���ձ�����������500ml����ƿ����ͷ�ι���������������Һʱ����Ҫ�������ǣ��������ձ�����ͷ�ιܡ�500ml����ƿ��
��3��A�����ձ����ܽ����ʱ������������Һ�ᵼ�����ʵ���ʧ��������Һ��Ũ��ƫ�ͣ���A��ȷ��B��û��������ˮϴ�ձ�2��3�Σ��ᵼ�����ʵ���ʧ����������Һ��Ũ��ƫ�ͣ���B��ȷ��C������ʱ���ӿ̶ȣ��ᵼ����Һ���ƫ����������Һ��Ũ��ƫ�ͣ���C��ȷ��D����������Һ������ƿת�Ƶ��Լ�ƿʱ����������������ʱ��Һ�����úã�װƿ�Ĺ�������ʧ��Һ����Ũ��û��Ӱ�죬��D����E��ϡ��H2SO4��û����ȴ�����¾�ת��������ƿ�����ݣ��ᵼ����Һ���ƫС��������ҺŨ��ƫ�ߣ���E������F��������ƿδ�������ҺŨ����Ӱ�죬��ΪֻҪ����ʱ��ȷ������ˮ��ԭ�����еĻ��Ǻ�������ģ���Ũ����Ӱ�죬��F����ѡABC��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ṥҵ�����ķ���A����Ҫ�ɷ֣�SO2��O2��N2��CO2�ȣ��ŷŵ������л���Ⱦ������ij��ѧ��ȤС��Է���A����ɽ���̽������ش��������⣮ 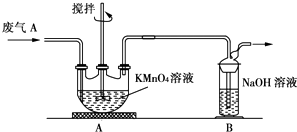
��1��ͬѧ�����ʵ��������A�к���CO2 �� Ӧѡ����Լ��� ��
A.NaOH��Һ
B.����KMnO4��Һ
C.����ʯ��ˮ
D.����
��2��ͬѧ�����ⶨ����A��SO2�ĺ�����ȡa L����A���������TUװ�ý���ʵ�飮
��Ϊ�˱�֤ʵ��ɹ���װ��AӦ���е������� �� �����Ŀ���� ��
��ͬѧ����ΪAװ��ǰ������������a L�����к��е�SO2��������Ȼ����к������㣮��С�����ۺ�ͬѧ��������ʣ�����ͬѧ����ʵ�飬��������SO2��ȫ�����գ������ⶨ�Ľ��Ӧ��ƫ��ͬѧ���ƶϵ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ž��з���Ƶĵ�һ��Ԫ�����ڱ���ΪԪ�صķ��ֺ��о�Ԫ��������ƽ�˵�·����ʱ�Ž��з����Ԫ���Ⱥ�˳���������(����)
A. ԭ�Ӱ뾶B. ԭ������
C. ���ԭ������D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2KMnO4+16HCl��Ũ��2KCl+2MnCl2+5Cl2��+8H2O��K2Cr2O7+14HCl��Ũ��2KCl+2CrCl3+3Cl2��+7H2O�� MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O������KMnO4��һ��Ũ�ȵ����ἴ�ɷ�Ӧ��K2Cr2O7��ͽ�Ũ����(����6 molL-1)��Ӧ��MnO2���Ũ����(����8 molL-1)��Ӧ������������Ϣ�����н���������ȷ����
MnCl2+Cl2��+2H2O������KMnO4��һ��Ũ�ȵ����ἴ�ɷ�Ӧ��K2Cr2O7��ͽ�Ũ����(����6 molL-1)��Ӧ��MnO2���Ũ����(����8 molL-1)��Ӧ������������Ϣ�����н���������ȷ����
A. ������Ӧ������������ԭ��Ӧ B. ����1 mol Cl2ת�Ƶ�������Ϊ2NA
C. ����Ũ��Խ��Cl���Ļ�ԭ��Խǿ D. �����ԣ�KMnO4>K2Cr2O7>Cl2>MnO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ʳ������Ա仯��ԭ���ǣ� ��
A.ԭ����������B.�˵����������
C.��������Ų��������Ա仯D.Ԫ�ػ��ϼ۳������Ա仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�¶��£�Ksp��AgCl��=1.56��10��10 �� Ksp��Ag2CrO4��=1��10��12 �� ���й��ڸ��¶��µ�������ȷ���ǣ� ��
A.���Ȼ���������Һ�м����Ȼ�����Һ��Ksp��AgCl����С
B.����AgCl��Һ�뱥��Ag2CrO4��Һ��ȣ�ǰ�ߵ�c��Ag+����
C.����0.0008molL��1��K2CrO4��Һ�м�������0.002 molL��1��AgNO3��Һ����CrO42������ȫ����
D.����0.001molL��1AgNO3��Һ����Ũ�Ⱦ�Ϊ0.001 molL��1��KCl��K2CrO4�����Һ�У����Ȳ���AgCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͨ��������Ϊ�ж���Ԫ�طǽ�����ǿ���������ǣ� ��
A.��̬�⻯���ȶ���ǿ��B.Ԫ��������ǿ��
C.����������Ӧˮ���������ǿ��D.�����۵�ߵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.����������ʵ���Ũ�ȵ�����������Һ��̼�������Һ��ϣ�Ba2++2OH��+NH4++HCO3��=BaCO3��+NH3H2O+H2O
B.�Ȼ�����Һ�м�������İ�ˮ��Al3++4 NH3H2O=4NH4++AlO2��+2H2O
C.����������Һ��ͨ�������Ķ�������Ca2++2ClO��+SO2+H2O=CaSO3��+2HClO
D.̼������Һ�м�������ı��ӣ� ![]() +CO32��=
+CO32��= ![]() +HCO3��
+HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ������������( )
A.�Ƿ��ȶ���B.����Ƿ��һC.�����ЧӦD.��ɢ������ֱ����С��ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com