
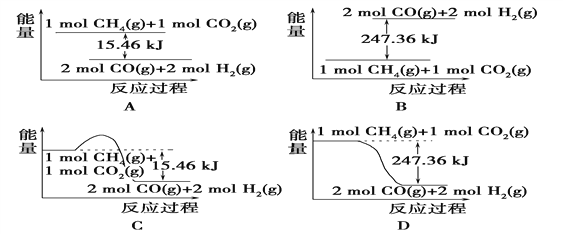
【题目】Ⅰ.甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
(1)下图能表示该反应过程中能量变化的是________(填字母)。
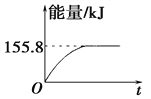
(2)若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化率为________。
Ⅱ. CO和H2也可由反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0得到。
CO(g)+3H2(g) ΔH>0得到。
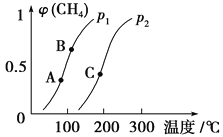
(1)一定条件下CH4的平衡转化率与温度、压强的关系如图。则p1________p2(填“<”、“>”或“=”)。A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为________________。
(2)100 ℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是________(填序号)。
a.容器的压强恒定 b.容器内气体密度恒定
c.3v正(CH4)=v逆(H2) d.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
Ⅲ.NH4HSO4在分析试剂、医药、电子工业中用途广泛。常温下,现向100 mL 0.1 mol·L1 NH4HSO4溶液中滴加0.1 mol·L1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
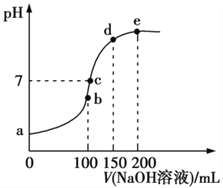
(1)b点时,溶液呈酸性的原因是____________________________。
(2)在c点,溶液中各离子浓度的关系正确的是____。
A.c(H+)+c(Na+)+c(NH4+)=c(OH)+2c(SO42-)
B.c(Na+)> c(NH4+)> c(SO42-)>c(H+)=c(OH)
C.c(Na+)> c(SO42-)> c(NH4+)>c(H+)=c(OH)
D.c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH)
Ⅳ.以H2、O2、熔融Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2。
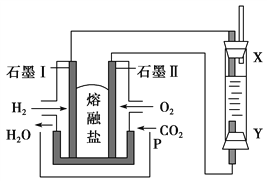
(1)石墨Ⅰ电极上的电极反应式为_________________________。
(2)通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是________(填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作电解液
C.阴极发生的反应是2H2O+2e-===H2↑+2OH-
D.白色沉淀只能在阳极上产生
【答案】 D 63.0% < KA<KB<KC ac NH4+水解使溶液呈酸性 AC H2-2e-+CO![]() ===CO2+H2O BC
===CO2+H2O BC
【解析】Ⅰ.(1) 1 g CH4完全反应可释放15.46 kJ的热量,则1mol甲烷即16g甲烷完全反应可释放15.46 kJ×16=247.36kJ的热量,由于反应物总能量高于生成物总能量,因此选项D符合,答案选D。(2)根据图像可知平衡时放热是155.8kJ,所以根据(1)中数据可知消耗甲烷是155.8/247.36=0.63mol,所以CH4的转化率为63.0%;
Ⅱ. CO和H2也可由反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0得到。
CO(g)+3H2(g) ΔH>0得到。
(1)正反应是体积增大的可逆反应,增大压强平衡向逆反应方向进行,甲烷的转化率降低,所以根据图像可知p1<p2。平衡常数只与温度有关系,正反应吸热,升高温度平衡向正反应方向进行,平衡常数增大,所以A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为KA<KB<KC。(2)a.正反应体积增加,当容器的压强恒定时反应达到平衡状态,a正确;b.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内气体密度恒定不能说明反应达到平衡状态,b错误;c.3v正(CH4)=v逆(H2)表示正逆反应速率相等,反应达到平衡状态,c正确;d.单位时间内消耗0.1 mol CH4同时一定生成0.3 mol H2,不能说明,d错误,答案选ac;
Ⅲ.(1)b点时加入100nL氢氧化钠,生成硫酸钠和硫酸铵,铵根水解溶液显酸性;(2)在c点溶液显中性,则A.根据电荷守恒可知c(H+)+c(Na+)+c(NH4+)=c(OH)+2c(SO42-),A正确;B.c是硫酸钠、硫酸铵和一水合氨的混合溶液,则c(Na+)>c(SO42-)> c(NH4+)>c(H+)=c(OH),B错误;C.根据B中分析可知C正确;D.根据B中分析可知D错误,答案选AC;
Ⅳ.(1)石墨Ⅰ通入氢气,是负极,电极上的电极反应式为H2-2e-+CO32-=CO2+H2O。(2)A.要制备氢氧化亚铁,则阳极材料必须是铁,阴极不一定是铁,A错误;
B.阳极产生的亚铁离子结合氢氧根转化为氢氧化亚铁,则可以用NaOH溶液作电解液,B正确;C.阴极发生得到电子的还原反应,即反应是2H2O+2e-=H2↑+2OH-,C正确;D.电解池中阳离子向阴极移动,与氢氧根结合生成白色沉淀氢氧化亚铁,D错误,答案选BC。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
A. CO2通入石灰水 B. AlCl3溶液中滴入NaOH溶液
C. NaHCO3溶液中滴入稀盐酸 D. 硫酸中加入锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、M为元素周期表中前四周期的元素,其原子序数依次增大。X与W、Z与R是分别同族元素;X原子的第一电离能小于同周期前一族元素的原子;Z元素基态原子的核外有3个未成对电子;M元素的单质化学性质稳定,耐腐蚀,其单质及合金是一种优良的航天、航空材料,M的基态原子核外有2个未成对电子。请回答下列问题:
⑴NaZ3可应用于汽车安全气囊,当汽车发生碰撞时,气囊中的NaZ3迅速分解产生大量Z 的单质气体,从而使安全气囊瞬间充气弹出,减轻了乘员受到的伤害。基态Z原子价电子的电子排布图为_____________。与Z3-互为等电子体的分子的化学式为______________(写一个即可),Z3-的空间构型是__________。
⑵W元素可形成[WF6]3-、[WCl4]-配离子,而X只能形成[XF4]-配离子,由此可知决定配合物中配位数多少的因素之一是________________;
⑶已知Y的最高价含氧酸根离子与Na+、K+、NH4+形成的酸式盐溶解度都小于其正盐的溶解度,原因是HCO3-之间以________(填作用力)作用形成长链,减小了HCO3-与水分子之间的作用导致溶解度降低;
⑷R元素通常有白、红、黑三种颜色的单质,其中最稳定的同素异形体G在通常状态下是一种黑色有金属光泽的晶体,G在储能、电子和光伏发电等领域有着广泛的应用前景,是一种比石墨烯更优秀的新型材料。晶体G具有与石墨类似的层状结构,如图一所示。下列有关G的说法正确的是_______________;
A.G中R原子杂化方式为sp3杂化
B.G中层与层之间的作用力是配位健
C.与石墨类似,G的每一层中R原子都在同一平面上
D.R元素三种常见的单质中,G的熔沸点最高
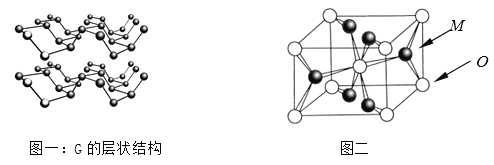
⑸M与O形成的离子晶体在自然界中存在三种形态,其中金红石型是三种形态中最稳定的一种,其晶胞如图二所示,则M、O配位数之比为________;影响离子晶体结构类型的因素有_____________、____________、键性因素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列几个反应的化学方程式:① 2KI+Cl2=2KCl+I2、② 2FeCl2+Cl2=2FeCl3、③ 2FeCl3+2HI=2FeCl2+I2+2HCl,下列有关物质的氧化性的强弱排列顺序中正确的是
A.Cl2>Fe3+>I2 B.Cl2>I2>Fe3+
C.Fe3+>Cl2>I2 D.Fe3+>I2>Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁4种易溶于水的物质,分别由![]() 、Ba2+、Mg2+、H+、
、Ba2+、Mg2+、H+、![]() 、
、![]() 、OHˉ、Clˉ中的不同阳离子和阴离子各一种组成。已知:
、OHˉ、Clˉ中的不同阳离子和阴离子各一种组成。已知:
①将足量的甲溶液分别与其他3种物质的溶液混合,均有白色沉淀生成
②0.1 molLˉ1乙溶液中c(H+)>0.1 mol·L1
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成
下列结论正确的是
A.甲溶液含有Ba2+ B.乙溶液不含![]()
C.丙溶液含有![]() D.丁溶液含有Mg2+
D.丁溶液含有Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下有三组混合物:①氯化钠和水;②硫酸钡和水;③煤油和水。分离以上混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 蒸发、过滤、分液 C. 分液、蒸发、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C. 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)=0.24 mol
D. 该温度下此反应的平衡常数:K=1.44
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com