

| A. | 该有机物在一定条件下可发生加聚反应 | |
| B. | 该有机物在一定条件下可发生银镜反应 | |
| C. | 1 mol该有机物在一定条件下可消耗2 mol Br2 | |
| D. | 1 mol该有机物最多可消耗2 mol NaOH |
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶液 | 该溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 向某溶液中滴入硝酸酸化硝酸银溶液产生白色沉淀 | 该溶液中一定含有Cl- |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的五色气体 | 该溶液中一定含有CO${\;}_{3}^{2-}$ |
| D | 向某溶液中加入氯化钡溶液,产生白色沉淀,生成白色沉淀,将沉淀过滤后,在沉淀中加入稀盐酸,沉淀部分溶解,并产生无色无味能使澄清石灰水变浑浊的气体 | 该溶液中既有CO${\;}_{3}^{2-}$又有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液和硫化钠溶液反应制备Al2S3 | |
| B. | 用镁粉和空气反应制备Mg3N2 | |
| C. | 用铝粉和MnO2制得锰 | |
| D. | 电解熔融氯化铝的方法制得单质铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
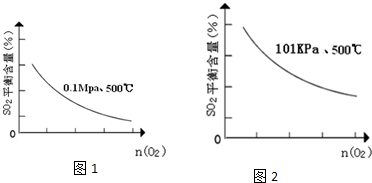
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液滴定盐酸,滴定前尖嘴下端有气泡,滴定后气泡消失,会使结果偏高 | |
| B. | 仰视量筒刻度量取一定量浓硫酸所配制的0.10 mol•L-1 H2SO4溶液的浓度结果偏低 | |
| C. | 焰色反应实验中,铂丝在蘸取待测溶液前应先用稀硫酸洗净并灼烧至无色 | |
| D. | 要将溶解在CCl4中的碘分离出来,以用蒸馏法,因为碘易升华,先分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com