
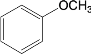
【题目】关于有机物a(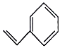 )、b(
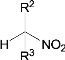
)、b(![]() )、c(
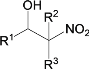
)、c(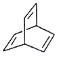 )的说法错误的是
)的说法错误的是
A.a、b、c互为同分异构体
B.a、b、c均能使酸性高锰酸钾溶液褪色
C.等物质的量a、c与足量氢气反应消耗氢气的物质的量之比是4∶3
D.a、b、c的一氯代物分别有5种、1种、2种(不考虑立体异构)
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是
A. 油脂在空气中完全燃烧转化为水和二氧化碳
B. 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 在浓硫酸存在下,苯与浓硫酸共热生成硝基苯的反应属于取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
(1)a________b(填“>”“=”或“<”)。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量ckJ,C的浓度________wmol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:________(用等式表示)。
(4)能说明该反应已经达到平衡状态的是________。
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前后气体压强相同),起始时加入2 mol A2和1 mol B2,500 ℃时充分反应达到平衡后,放出热量dkJ,则d________b(填“>”“=”或“<”),理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】去甲肾上腺素是一种重要的神经递质,以石油裂解产物A和邻甲氧基苯酚为原料,经过中间体藜芦醛,合成去甲肾上腺素的路线如下所示。
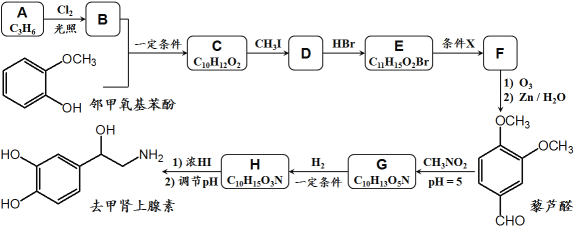
已知:①
![]()
![]()

②![]()
![]()
![]() +
+![]()
③![]() +
+
![]()
④D和F互为同分异构体。
回答下列问题:
(1)C → D的反应类型为__________,G → H的反应类型为__________;
(2)条件X为__________,E在条件X作用下发生变化的官能团名称为__________;
(3)关于上述合成,下列说法正确的是__________;(填序号)
a.1mol邻甲氧基苯酚能与3mol Br2发生取代反应
b.合成路线中CH3I和浓HI的作用是保护酚羟基不被O3氧化
c.藜芦醛分子中至少有14个原子共平面
d.1mol去甲肾上腺素熔化后至多可消耗3mol Na和2mol NaOH
(4)B + 邻甲氧基苯酚 → C的化学方程式为_______________________________;
(5)藜芦醛的同系物Y相对分子质量比藜芦醛大14,写出Y满足下列条件所有同分异构体的结构简式:
①能发生银镜反应;②1mol该有机物能消耗2mol NaOH(aq);③核磁共振氢谱有4组峰
__________________________________________________________;
(6)试设计以间苯二酚(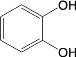 )为原料,制备聚酯
)为原料,制备聚酯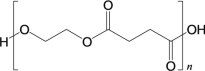 的合成路线。(无机试剂任选,仅可使用间苯二酚作有机原料)___________
的合成路线。(无机试剂任选,仅可使用间苯二酚作有机原料)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条作下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0。查阅资料知SO3的熔点为16.83℃,沸点是448℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。
2SO3(g) △H<0。查阅资料知SO3的熔点为16.83℃,沸点是448℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。
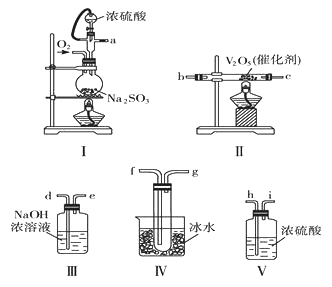
请根据要求回答问题:
(1)各装置接口的连接顺序是a→_________________。
(2)装置Ⅳ烧杯中盛放冰水的作用是_____________________。
(3)装置Ⅰ所用硫酸,一般选用浓度为70%~80%的硫酸,原因是_________________。
(4)当装置Ⅰ中反应结束时,要打开止水夹继续通入O2一段时间,继续通入O2的目的是_______。
(5)称量agNa2SO3粉末与足量硫酸反应,实验结束后称得装置Ⅳ增重bg,列式表示该实验中SO2的转化率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯常用于食用香精配方中,可调配香蕉、苹果、草莓等多种果香型香精。实验室制备乙酸异戊酯的反应为CH3COOH+(CH3)2CHCH2CH2OH![]() CH3COOCH2CH2CH(CH3)2+H2O,实验装置如图所示。
CH3COOCH2CH2CH(CH3)2+H2O,实验装置如图所示。
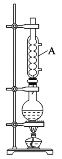
实验步骤如下:①在100 mL圆底烧瓶中加入一定体积的异戊醇和冰乙酸,摇匀后小心加入4 滴浓硫酸,投入1~2粒沸石。如图装置隔石棉网用酒精灯加热,回流反应30 min。
②待反应物冷却至室温,将其转移到100 mL分液漏斗中,依次用蒸馏水荡洗圆底烧瓶两次,荡洗液全部转入分液漏斗中,静置分层分离,弃水层,有机层加入NaHCO3溶液不断振荡,静置分层,分去水层。
③分出水层后的有机层转入干燥的锥形瓶中,加入约0.10 g无水硫酸镁,加盖静置10 min。然后液体转入100 mL圆底烧瓶中,加两粒沸石,装上直形冷凝管、接液管,常压下蒸馏,收集140~143℃馏分得产物。
(1)步骤①中加入沸石的目的是______,仪器A的名称是______。
(2)步骤②中,水洗的主要目的是______,NaHCO3洗涤完成的标志是______。
(3)步骤③中加入少量无水MgSO4的目的是______。
(4)用测相对分子质量的方法可检验所得产物是否纯净,测相对分子质量通常采用的仪器是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备。工艺流程如下:
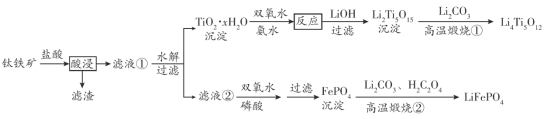
“酸浸”后,钛主要以![]() 形式存在,若“滤液②”中c(Mg2+)=0.02 mol ·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成? 已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-2 _____________(列式计算)。
形式存在,若“滤液②”中c(Mg2+)=0.02 mol ·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成? 已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-2 _____________(列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种邮寄材料中间体。实验室由芳香烃A制备H的一种合成路线如下:
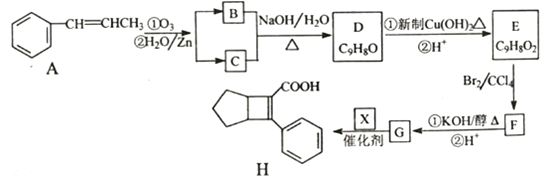
已知:①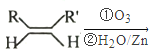 RCHO+RCHO
RCHO+RCHO
②RCHO+RCH2CHO![]() +H2O
+H2O
③![]()
请回答下列问题:
(1)芳香化合物B的名称为_________,C的同系物中相对分子质量最小的结构简式为__________。
(2)由E生成F的反应类型为_________。
(3)X的结构简式为_________。
(4)写出D生成E的第①步反应的化学方程式_______________。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有____种,写出其中任意一种的结构简式________。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2;
②其核磁共振氢谱显示有4种不同化学键环境的氢,且峰面积之比为6:2:1:1。
(6)写出用![]() 为原料制备化合物
为原料制备化合物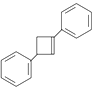 的合成路线,其他无机试剂任选。________
的合成路线,其他无机试剂任选。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
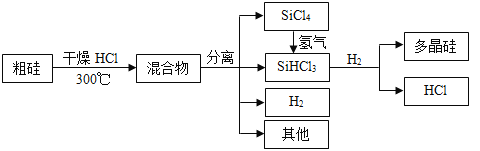
回答下列问题:
Ⅰ.硅粉与![]() 在300℃时反应生成
在300℃时反应生成![]() 气体和
气体和![]() ,放出
,放出![]() 热量,该反应的热化学方程式为________________________。
热量,该反应的热化学方程式为________________________。![]() 的电子式为__________________。
的电子式为__________________。
Ⅱ.将![]() 氢化为
氢化为![]() 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①![]()
![]()
②![]()
![]()
③![]()
![]()
(1)氢化过程中所需的高纯度![]() 可用惰性电极电解
可用惰性电极电解![]() 溶液制备,写出产生
溶液制备,写出产生![]() 的电极名称______(填“阳极”或“阴极”),该电极反应方程式为________________________。
的电极名称______(填“阳极”或“阴极”),该电极反应方程式为________________________。
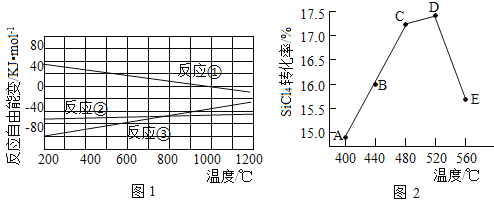
(2)已知体系自由能变![]() ,
,![]() 时反应自发进行。三个氢化反应的
时反应自发进行。三个氢化反应的![]() 与温度的关系如图1所示,可知:反应①能自发进行的最低温度是____________;相同温度下,反应②比反应①的
与温度的关系如图1所示,可知:反应①能自发进行的最低温度是____________;相同温度下,反应②比反应①的![]() 小,主要原因是________________________。
小,主要原因是________________________。
(3)不同温度下反应②中![]() 转化率如图2所示。下列叙述正确的是______(填序号)。
转化率如图2所示。下列叙述正确的是______(填序号)。
a.B点: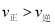 b.
b.![]() :A点
:A点![]() 点 c.反应适宜温度:
点 c.反应适宜温度:![]() ℃
℃
(4)反应③的![]() ______(用
______(用![]() ,
,![]() 表示)。温度升高,反应③的平衡常数
表示)。温度升高,反应③的平衡常数![]() ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
(5)由粗硅制备多晶硅过程中循环使用的物质除![]() 、
、![]() 和
和![]() 外,还有______(填分子式)。
外,还有______(填分子式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com