
可逆反应N2(g)+ 3H2(g) 
 2NH3 (g)达到平衡状态,下列说法中正确的是( )
2NH3 (g)达到平衡状态,下列说法中正确的是( )
| A.该反应停止,N2和H2不再化合 | B.N2、H2、NH3浓度不变 |
| C.N2、H2、NH3浓度相等 | D.N2、H2、NH3的物质的量之比为1:3:2 |
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:单选题
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应A(s)+2B(g)  C(g)+D(g)已达到平衡状态①各气体物质的物质的量浓度②气体的总物质的量③混合气体的压强④混合气体的密度
C(g)+D(g)已达到平衡状态①各气体物质的物质的量浓度②气体的总物质的量③混合气体的压强④混合气体的密度
| A.只有①② | B.只有①④ | C.只有①③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一个体积不变的密闭容器中发生可逆反应:A2(g)+B2(g) 2AB(g),达到平衡的标志是
2AB(g),达到平衡的标志是
A.容器的总压强不随时间而变化 B.容器内气体的密度不再改变
C.单位时间内有nmolA2生成的同时有nmolB2消耗 D. v正(A2)= 2v逆(AB)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
| A.60 s内X的平均反应速率为0.001 mol·L-1·s-1 |
| B.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2 |
| C.若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
科学家一直致力于“人工固氮”的新方法研究。目前合成氨技术原理为:
N2(g) + 3H2(g) 2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )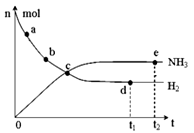
| A.点a的正反应速率比点b的大 |
| B.点c处反应达到化学平衡状态 |
| C.点d和点e处的n(N2)不相同 |
| D.点e反应达到化学平衡状态,反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在t℃时,10mL0.4mol·L-1H2O2溶液发生催化分解:2H2O2 = 2H2O + O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表
| t /min | 0 | 2 | 4 | 6 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实不能用勒夏特列原理解释的是 ( )
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| B.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率; |
| C.过氧化氢分解加二氧化锰作催化剂,使单位时间内产生的氧气的量多。 |
| D.久制的氯水PH值变小。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com