
 Al(OH)4- + H+ (B) NH3 + H2O
Al(OH)4- + H+ (B) NH3 + H2O  NH4+ + OH-
NH4+ + OH-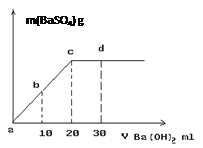
 B(OH)4- + H+ (2分)
B(OH)4- + H+ (2分)  N2H62+ +2OH_或分部水解均可 (2分)
N2H62+ +2OH_或分部水解均可 (2分)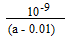 (2分)
(2分)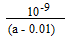 。
。

科目:高中化学 来源:不详 题型:填空题
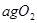 同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为
同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为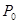 ,高温下容器中木炭与
,高温下容器中木炭与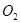 均完全反应后恢复到原温度,压力表的示数为
均完全反应后恢复到原温度,压力表的示数为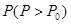 ,试求:
,试求: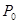 表示)是______。
表示)是______。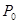 之间必须满足函数系W=f(a、
之间必须满足函数系W=f(a、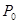 、P),写出该函数表达式:__________________。
、P),写出该函数表达式:__________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4CuSO3中硫元素被氧化了 | B.刺激性气味的气体是二氧化硫或氨气 |
| C.该反应中NH4CuSO3既是氧化剂又是还原剂 | D.该反应中硫酸既表现为酸性又表现氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤⑥ | B.②④ | C.②④⑥ | D.①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
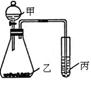
| 实验试剂 | 实验结论 | ||
| 甲 | 乙 | 丙 | |
| ① | 高锰酸钾 | ② | 氧化性:KMnO4>Cl2>Br2 |
 (1)图中①为 ,②为 。
(1)图中①为 ,②为 。 (2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;
(2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;| 试剂甲 | 试剂乙 | 试剂丙 | 丙中现象 | 实验结论 |
| | | | | 酸性:盐酸>碳酸 |
| | | 石蕊试液 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com