
下列实验方案可行的是( )
A.加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B.用萃取的方法分离汽油和煤油
C.用溶解、过滤的方法分离KNO3和NaCl固体的混合物
D.将O2和H2的混合物通过灼热的氧化铜,以除去其中的H2
科目:高中化学 来源: 题型:
绿原酸的结构简式如图所示下列有关绿原酸的说法不正确的是
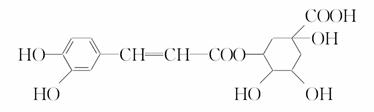
A.分子式为C16H18O9
B.0.1 mol绿原酸最多与0.8 mol NaOH反应
C.能与Na2CO3反应
D.能发生取代反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石)ΔH = +1.9kJ/mol”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH = - 57.3kJ/mol,若将含
1molCH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧
的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)ΔH = —285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol·L—1和 b mol·L—1,则a 与b 的关系为( )
A.a=b B. a=2b C. 2a=b D. a=5b
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中物质的量浓度为1 mol·L-1的是( )。
A.将40 g NaOH固体溶解于1 L水中
B.将22.4 L氯化氢气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1的浓盐酸与9 L水混合
D.10 g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列溶液中的杂质(括号内的物质),下列做法不正确的是( )
A.NaCl溶液(BaCl2),加Na2SO4溶液,过滤
B.KNO3溶液(AgNO3),加NaCl溶液,过滤
C.NaCl溶液(I2),加酒精,分液
D.KNO3溶液(I2),加四氯化碳,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如下图所示。利用标签所提供的信息,回答下列问题:
| 5%葡萄糖注射液 |
(1)该注射液中葡萄糖的质量分数为________________。
(2)该注射液中葡萄糖的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型);
 (2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长 a = cm。 (用含ρ、NA的计算式表示)
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长 a = cm。 (用含ρ、NA的计算式表示)
(3)下列有关的说法正确的是 。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
① Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为 。
② 化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
③ 元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com