
【题目】下列说法中正确的是( )
A.所有烷烃和蛋白质中都存在碳碳单键
B.乙醇与乙酸存在相同官能团
C.乙烷能发生加聚反应
D.米酒变酸的过程涉及了氧化反应
科目:高中化学 来源: 题型:
【题目】工业上通过电化学原理在铝片表面形成氧化膜来提高其抗腐蚀能力,工作原理如下图所示。列说法正确的是
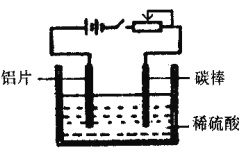
A. 碳棒可用任意金属代替,其作用是传递电流
B. 通电一段时间后,溶液的pH增大
C. 通电后电子被强制从碳棒流向铝片使铝表面形成氧化膜
D. 可通过调节滑动变阻器来控制氧化膜的形成速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)SO2在烟尘的催化下形成硫酸的反应方程式是______________.
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
①写出NO2和SO2反应的热化学方程式为_________.
②随温度升高,该反应化学平衡常数变化趋势是_____.
(3)提高2SO2+O22SO3反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在1L的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是____.
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_____(填字母).
a.温度和容器体积不变,充入1.0mol He b.温度和容器体积不变,充入1.0mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图。

①电解饱和食盐水的化学方程式是________________.
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是_________.
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如右图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 四种元素的单质中,Z单质的熔、沸点最低
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用NaOH溶液吸收尾气中的H2S气体,再将得到的Na2S溶液进行电解制得NaOH溶液,以实现NaOH的循环利用。电解装置如图所示,电极材料均为石墨,ab、cd均为离子交换膜。下列叙述不正确的是
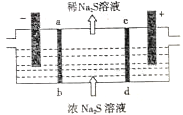
A. ab表示阳离子交换膜,cd表示阴离子交换膜
B. 阳极的电极反应式为S2--2e-==S↓,阳极区有淡黄色沉淀产生
C. 阴极的电极反应式为2H2O-4e-==O2↑+4H+,阴极区溶液pH降低
D. 当电路中转移1mol电子时,会有11.2L(标准状况)的气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关滴定操作的顺序正确的是:①用标准溶液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤洗涤( )
A. ③⑤①②④ B. ⑤①②③④ C. ⑤②③①④ D. ②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化锂是一种高效的水汽吸收剂,其一种绿色工业合成工艺如下(部分操作和条件已略去)。
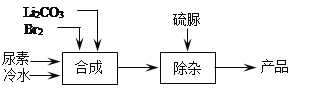
已知:碳酸锂微溶于水,水溶液显碱性。
(1)Br2的电子式是______。
(2)合成过程中发生的反应如下,请写出ii反应的化学方程式并将iii补充完整。
ⅰ. Br2 +H2O![]() HBr +HBrO;
HBr +HBrO;
ⅱ._____;
ⅲ. 3LiBrO + CO(NH2)2(尿素)=3LiBr+_____。
(3)LiBrO3是生产过程中的副产物。
①用化学方程式表示生成改副产物的原因:______。
②为了提高原料的利用率,减少副产物的生成,必须调控体系的pH在3~5之间,通过合理的加料方法来实现:将碳酸锂粉末溶解于冷的溴水中至饱和,并一次性加入尿素,然后再______,直到尿素完全转化。
③常用硫脲除去LiBrO3,反应的化学方程式是4LiBrO3 +3CS(NH2)2(硫脲) +3H2O=4LiBr +3CO(NH2)2 +3H2SO4 ,选用硫脲除杂的优点是_______;缺点是引入新杂质且溶液酸性增强,为解决该问题需要加入的试剂是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com