
【题目】工业上通过电化学原理在铝片表面形成氧化膜来提高其抗腐蚀能力,工作原理如下图所示。列说法正确的是
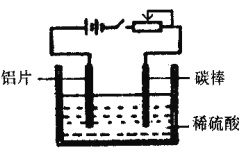
A. 碳棒可用任意金属代替,其作用是传递电流
B. 通电一段时间后,溶液的pH增大
C. 通电后电子被强制从碳棒流向铝片使铝表面形成氧化膜
D. 可通过调节滑动变阻器来控制氧化膜的形成速度
科目:高中化学 来源: 题型:
【题目】工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)![]() 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4容易与H+反应产生氢气而成为储氢材料研究的热点。以硼酸为原料制备NaBH4的一种工艺流程如下图所示:
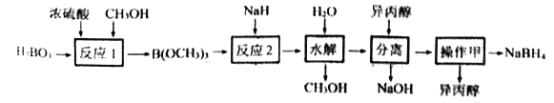
已知: ①H3BO3电离:H3BO3+H2O![]() [B(OH)4]-+H+
[B(OH)4]-+H+
②反应1: H3BO3+3CH3OH![]() B(OCH3)3+3H2O
B(OCH3)3+3H2O
③反应2:B(OCH3)3+4NaH= NaBH4+ 3CH3ONa
(1)H3BO3是____元酸,NaH的电子式为_______________。
(2)NaBH4与水剧烈反应放出H2。反应的化学方程式为________________。
(3)反应1属于______(填有机反应类型),反应过程中蒸出B(OCH3)3的目的是__________。
(4)“水解”时产生的大量NaOH,减缓了NaBH4与水的反应。在该步骤中,与水反应生成大量NaOH的物质是_________。
(5)“分离”后得到NaBH4的异丙醇溶液。操作甲是_____________。
(6)上述流程中可以循环使用的物质是____________。
(7)以惰性电极电解Na[B(OH)4]与NaOH 混合溶液也能制得NaBH4。阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的尾气主要成分为N2、NO、CO、CO2、SO2等,某兴趣小组设计以下实验,定量检测尾气中污染性气体的含量。
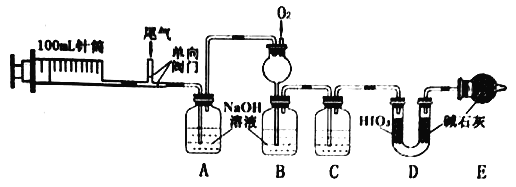
(1)实验时,先推送N2,再连续抽送20次(100mL/次)尾气,最后推送N2。
①第一次推送N2的作用是________。
②尾气采用多次抽送方式的目的是________。
(2)C中的试剂是____________。
(3)装置D用于测量CO。
①HIO3能氧化CO,还原产物为I2,反应的化学方程式为____________。
②D中碱石灰的作用是_________。
(4)为进一步分析SO2含量,将实验后A中溶液转移到烧杯,依次加入三种试剂,过滤、洗涤、干燥。称得沉淀为1.165g。
①加入的三种试剂为_______。(选填序号)
a.盐酸 b.双氧水 c.BaCl2溶液 d.稀硫酸
②检验沉淀是否洗涤干净的方法是_____________。
③尾气中SO2含量为_____gL-1。
(5)实验后,测得B中溶液体积为100mL,NO2-、NO3- 的浓度分别为0.0100molL-1和0.0200molL-1。
①B中长颈漏斗的作用是_____________;
②通入O2的体积(标准状况)至少为___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)十O2(g)![]() 2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
Ⅰ:V2O5+ SO2→2VO2 +SO3(快) Ⅱ: 4VO2+O2→2V2O5(慢),下列说法正确的是( )
A. 反应速率主要取决于Ⅰ步反应
B. 该反应逆反应的活化能大于198kJ/mol
C. 2molSO2和1molO2在一定条件下充分反应能放出198KJ的热量
D. 在恒温、恒容条件下,达到平衡后继续加入少量SO3平衡将向正反应方向移动,所以SO3的体积百分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家韦尔斯泰特,经过10年的艰苦努力,韦尔斯泰特用成吨的绿叶,终于提取到了绿叶中的神秘物质——叶绿素,正是因为叶绿素在植物体内所起到的奇特作用,才使我们人类得以生存。可以说,没有光合作用就没有人类的生存和发展。由于成功地提取了叶绿素,1915年,韦尔斯泰特荣获了诺贝尔化学奖。叶绿素的结构如图
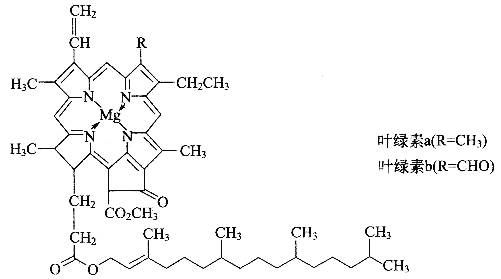
(1)光合作用产生氧气,氧气的一种同素异形体O3,在高空能吸收大量紫外线,保护地球上的人类和动植物免遭短波紫外线的伤害。请写出一种短周期元素形成的O3等电子体分子________,该分子的空间构型为________,中心原子的杂化类型是_________。
(2)镁是叶绿素中的重要组成元素,镁的基态原子价电子排布式为__________,叶绿素中镁形成的化学键类型有___________________。叶绿素不易溶于水,而溶于有机溶剂,如乙醇、丙酮、乙醚、氯仿等,是因为______________________________。
(3)叶绿素构成元素中,又属于二周期元素中,第一电离能由大到小的顺序(请用元素符号表示):_______________,理由是______________________________。
(4)叶绿素的构成元素中,H和Mg属于第一、三周期的元素,能形成一种离子型储氢材料,晶体结构如图所示:
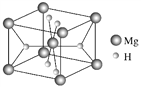
则 该晶体的化学式为__________________,已知该晶体的密度为ρ g·cm-3,晶胞的体积为________ cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-Q kJ/mol(Q>0)
2NH3(g) ΔH=-Q kJ/mol(Q>0)
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
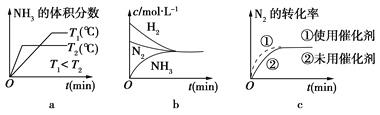
(3)某温度下,若把2 mol N2与6 mol H2置于体积为1 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1_______Q。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.所有烷烃和蛋白质中都存在碳碳单键
B.乙醇与乙酸存在相同官能团
C.乙烷能发生加聚反应
D.米酒变酸的过程涉及了氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com