
【题目】某工厂的尾气主要成分为N2、NO、CO、CO2、SO2等,某兴趣小组设计以下实验,定量检测尾气中污染性气体的含量。
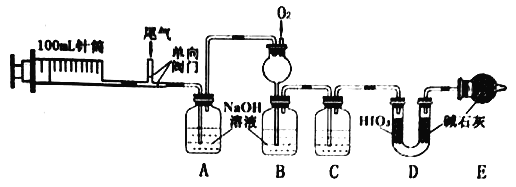
(1)实验时,先推送N2,再连续抽送20次(100mL/次)尾气,最后推送N2。
①第一次推送N2的作用是________。
②尾气采用多次抽送方式的目的是________。
(2)C中的试剂是____________。
(3)装置D用于测量CO。
①HIO3能氧化CO,还原产物为I2,反应的化学方程式为____________。
②D中碱石灰的作用是_________。
(4)为进一步分析SO2含量,将实验后A中溶液转移到烧杯,依次加入三种试剂,过滤、洗涤、干燥。称得沉淀为1.165g。
①加入的三种试剂为_______。(选填序号)
a.盐酸 b.双氧水 c.BaCl2溶液 d.稀硫酸
②检验沉淀是否洗涤干净的方法是_____________。
③尾气中SO2含量为_____gL-1。
(5)实验后,测得B中溶液体积为100mL,NO2-、NO3- 的浓度分别为0.0100molL-1和0.0200molL-1。
①B中长颈漏斗的作用是_____________;
②通入O2的体积(标准状况)至少为___________mL。
【答案】 排尽装置中的空气 减小相对误差 浓硫酸 2HIO3+ 5CO = I2 + 5CO2 + H2O 吸收 CO2和 H2O abc 取最后一次洗涤液少许于试管中,加入硝酸酸化的AgNO3溶液, 若无白色沉淀生成,则沉淀洗涤干净,反之沉淀未洗净 0.16 使 NO 和O2充分混合, 防止倒吸 39.2
【解析】本题考查实验方案设计与评价,(1)①第一次通入N2的目的排尽装置中的空气,防止NO与O2发生反应;②尾气采用多次抽送方式,其目的是减小相对误差;(2)装置DHIO3把CO氧化成CO2,装置E吸收CO2,从而计算CO的量,从B中出来的气体中含有水蒸气,能被碱石灰吸收,干扰CO量的测定,因此装置C中盛放的试剂为浓硫酸;(3)①HIO3把CO氧化成CO,本身被还原成I2,即HIO3+CO→CO2+I2+H2O,根据化合价升降进行配平,化学反应方程式为2HIO3+ 5CO = I2 + 5CO2 + H2O;②碱石灰的作用是吸收装置D中产生的CO2和H2O;(4)①装置A中NaOH吸收SO2和CO2,转化成Na2SO3和Na2CO3,测定SO2,应向A溶液中加入盐酸,除去Na2CO3,然后滴加H2O2,把+4价S氧化成SO42-,最后滴加BaCl2溶液,生成BaSO4沉淀;②沉淀表面为NaCl,证明沉淀已洗净的方法是取最后一次洗涤液少许于试管中,加入硝酸酸化的AgNO3溶液, 若无白色沉淀生成,则沉淀洗涤干净,反之沉淀未洗净;③根据硫元素守恒,n(SO2)=n(BaSO4)=1.165/233mol=0.005mol,因此尾气中SO2的含量为![]() ;(5)①B中长颈漏斗的作用是使NO和O2充分混合,以及防止倒吸;②发生的反应是2NO+O2=2NO2、2NO2+2NaOH=NaNO2+NaNO3+H2O,还有一部分氧气把部分NaNO2氧化成NaNO3,根据得失电子数目守恒,有n(O2)×4=n(NO2-)×1+n(NO3-)×3=100×10-3×0.01×1+100×10-3×0.02×3,解出n(O2)=1.75×10-3mol,即氧气体积至少为1.75×10-3×22.4×10-3mL=39.2mL。
;(5)①B中长颈漏斗的作用是使NO和O2充分混合,以及防止倒吸;②发生的反应是2NO+O2=2NO2、2NO2+2NaOH=NaNO2+NaNO3+H2O,还有一部分氧气把部分NaNO2氧化成NaNO3,根据得失电子数目守恒,有n(O2)×4=n(NO2-)×1+n(NO3-)×3=100×10-3×0.01×1+100×10-3×0.02×3,解出n(O2)=1.75×10-3mol,即氧气体积至少为1.75×10-3×22.4×10-3mL=39.2mL。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】下列有关SO2气体的实验现象中不正确的是( )
A.装满SO2气体的试管倒立在滴有紫色石蕊的水槽中,进入试管的液体呈红色
B.将SO2气体通入装有品红溶液的试管里,红色逐渐褪去,给试管加热无明显变化
C.打开盛有SO2气体的集气瓶口的玻璃片,可闻到刺激性气味
D.将SO2气体通入装有溴水溶液的试管里,橙红色逐渐褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M为海洋天然产物(一)-PavidolideB不对称全合成的中间体之一,结构简式如下图。下列有关M的说法不正确的是

A. 分子式为C10H14O
B. 可发生取代反应加成反应、聚合反应
C. 分子中所有碳原子都在同一平面上
D. 苯环上连有-OH和-C4H9的M的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,则下列叙述中正确的是
A. 6.02×1022个H2SO分子在水中可电离生成2NA个H+
B. 在0℃、101kPa时,22.4L氢气中含有NA个氢原子
C. 14g氮气中含有7NA个电子
D. NA个一氧化碳分子和0.5mol甲烷的质量比为7︰4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以异丙苯(A)为原料合成(±)-水芹醛(C10H16O)的路线如下:

(1)(土)-水芹醛的官能团名称为______、_______。
(2)G→H反应的方程式为_____________。
(3)H→I的反应类型为_____________。
(4)B、K的结构简式分别为_____________、_____________。
(5)鉴别J和(土)一水芹醛可选用的试剂为___________。
a.NaHCO3溶液 b.溴水 c.酸性KMnO4溶液 d.新制Cu(OH)2
(6)满足下列条件的D的同分异构体有___种,其中核磁共振氢谱为1:1:2:2:6的结构简式为____。
①能与金属钠反应产生氢气;
②不能使FeCl3溶液显色;
③含有苯环且苯环上不超过两个取代基。
(7)依据题中信息,参照上述路线,以![]() 为原料,选择必要试剂设计
为原料,选择必要试剂设计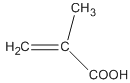 的合成路线____________。
的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。

请回答该实验中的问题。
(1)实验前必须对整套装置进行气密性的检查,操作方法是_____________。
(2)圆底烧瓶中盛装的是水,该装置受热后的主要作用是_______________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_______________。
(3)酒精灯和酒精喷灯点燃的顺序是__________。
(4)干燥管中盛装的物质可以是_____________,作用是__________。
(5)如果要在A处玻璃管口处点燃该气体,则必须对该气体进行_________,这一操作的目的_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过电化学原理在铝片表面形成氧化膜来提高其抗腐蚀能力,工作原理如下图所示。列说法正确的是
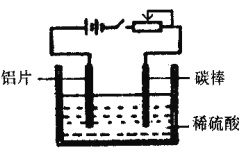
A. 碳棒可用任意金属代替,其作用是传递电流
B. 通电一段时间后,溶液的pH增大
C. 通电后电子被强制从碳棒流向铝片使铝表面形成氧化膜
D. 可通过调节滑动变阻器来控制氧化膜的形成速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)SO2在烟尘的催化下形成硫酸的反应方程式是______________.
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
①写出NO2和SO2反应的热化学方程式为_________.
②随温度升高,该反应化学平衡常数变化趋势是_____.
(3)提高2SO2+O22SO3反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在1L的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是____.
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_____(填字母).
a.温度和容器体积不变,充入1.0mol He b.温度和容器体积不变,充入1.0mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图。

①电解饱和食盐水的化学方程式是________________.
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是_________.
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是___________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com