
ЁОЬтФПЁПЙЄвЕжЦСђЫсЕФЙиМќВНжшжЎвЛЮЊSO2ЕФНгДЅбѕЛЏЃК2SO2ЃЈgЃЉ+O2ЃЈgЃЉ![]() 2SO3ЃЈgЃЉЃЛЁїH=-196.6kJ/mol
2SO3ЃЈgЃЉЃЛЁїH=-196.6kJ/mol
ЯждквЛШнЛ§ЮЊ2 LЕФУмБеШнЦїжаГфШы2 mol SO2ЁЂ1 molO2ЃЌМгШыЙЬЬхДпЛЏМСЃЌБЃГжЮТЖШдк450ЁцЪЙжЎЗЂЩњЗДгІЃЌ5 minЪБДяЕНЦНКтЃЌВтЕУЦНКтЪБЬхЯЕЕФбЙЧПМѕаЁСЫ30ЃЅЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
AЃЎSO2ЕФзЊЛЏТЪЮЊ30ЃЅ
BЃЎЗДгІЙВЗХГіСЫ196.6 kJЕФШШСП
CЃЎгУSO2БэЪОЕФ5 minФкЕФЦНОљЗДгІЫйТЪЮЊ0.36 molЁЄLЁЊ1ЃЎminЁЊ1
DЃЎЯрЭЌЬѕМўЯТЃЌЦ№ЪМЪБШєМгШы2 molSO3ЃЌДяЕНЕФЦНКтзДЬЌЭъШЋЯрЭЌ
 аЁбЇНЬВФШЋВтЯЕСаД№АИ
аЁбЇНЬВФШЋВтЯЕСаД№АИ аЁбЇЪ§бЇПкЫуЬтПЈЭбПкЖјГіЯЕСаД№АИ
аЁбЇЪ§бЇПкЫуЬтПЈЭбПкЖјГіЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈПЩвджЄУїЗДгІN2(g)+3H2(g)![]() 2NH3(g)вбДяЕНЦНКтзДЬЌЕФЪЧ
2NH3(g)вбДяЕНЦНКтзДЬЌЕФЪЧ
A. 1ИіNЁдNМќЖЯСбЕФЭЌЪБ,га3ИіHЁЊHМќаЮГЩ
B. 1ИіNЁдNМќЖЯСбЕФЭЌЪБ,га3ИіHЁЊHМќЖЯСб
C. N2ЁЂH2ЁЂNH3ЕФЗжзгЪ§жЎБШЮЊ1ЁУ3ЁУ2
D. 1ИіNЁдNМќЖЯСбЕФЭЌЪБ,га6ИіHЁЊNМќаЮГЩ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМзЊЛЏЙиЯЕжаЕФmЁЂnЁЂpЁЂqОљКЌТШдЊЫиЕФГЃМћЮяжЪЃЌЦфжаpЁЂqЮЊЫсЃЌnЮЊЕЅжЪЃЌЯТСаа№ЪіВЛе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
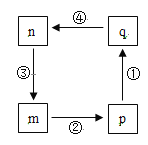
A. nдкБъПіЯТЕФУмЖШдМЮЊ3.17 gЁЄL-1
B. ЗДгІЂлжаЮяжЪnгыЕчзгзЊвЦЕФЮяжЪЕФСПЯрЕШ
C. pбѕЛЏадЧПгкq
D. ЫФВНЗДгІОљЮЊбѕЛЏЛЙдЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиSO2ЦјЬхЕФЪЕбщЯжЯѓжаВЛе§ШЗЕФЪЧ( )
A.зАТњSO2ЦјЬхЕФЪдЙмЕЙСЂдкЕЮгазЯЩЋЪЏШяЕФЫЎВлжаЃЌНјШыЪдЙмЕФвКЬхГЪКьЩЋ
B.НЋSO2ЦјЬхЭЈШызАгаЦЗКьШмвКЕФЪдЙмРяЃЌКьЩЋж№НЅЭЪШЅЃЌИјЪдЙмМгШШЮоУїЯдБфЛЏ
C.ДђПЊЪЂгаSO2ЦјЬхЕФМЏЦјЦППкЕФВЃСЇЦЌЃЌПЩЮХЕНДЬМЄадЦјЮЖ
D.НЋSO2ЦјЬхЭЈШызАгафхЫЎШмвКЕФЪдЙмРяЃЌГШКьЩЋж№НЅЭЪШЅ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЪЕбщВйзїЁЂЯжЯѓКЭНтЪЭЛђНсТлЖМе§ШЗЕФЪЧ
бЁЯю | ЪЕбщВйзї | ЯжЯѓ | НтЪЭЛђНсТл |
A | НЋNa2CO3ШмвКгЩ0.1mol/L ЯЁЪЭЕН0.01mol/LЃЌВтШмЖЩpH | ШмвКpHБфаЁ | ЯЁЪЭКѓCO32-ЕФЫЎНтГЬЖШМѕаЁ |
B | ЯђвЛЖЈХЈЖШЕФCuSO4ШмвКжа ЭЈШыЪЪСПЕФH2SЦјЬх | ГіЯжКкЩЋГСЕэ | H2SЕФЫсадБШH2SO4ЧП |
C | НЋЪЂгазиКьЩЋNO2ЦјЬхЕФзЂЩф ЦїгЩ10 mL бЙЫѕжС5 mL | ЦјЬхбеЩЋБШбЙ ЫѕЧАБфЧГ | ЗДгІ2NO2 |
D | дкаТЩњГЩЕФAgCl ГСЕэжаЕЮШы ЯЁKIШмвКЃЌеёЕД | АзЩЋГСЕэзЊЛЏЮЊ ЛЦЩЋГСЕэ | Ksp (AgCl )>Ksp (AgI) |
A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзДМЪЧвЛжжПЩдйЩњФмдДЃЌОпгаЙуЗКЕФПЊЗЂКЭгІгУЧАОАЁЃЙЄвЕЩЯвЛАуВЩгУЯТСаЗДгІКЯГЩМзДМ:CO2(g)+3H(g)![]() CH3OH(g)+H2O(g)ЁЃдкЬхЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌГфШы2molCO2КЭ9molH2ЃЌВтЕУCO2(g)КЭCH3OH(g)ХЈЖШЫцЪБМфБфЛЏШчЭМЫљЪО:
CH3OH(g)+H2O(g)ЁЃдкЬхЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌГфШы2molCO2КЭ9molH2ЃЌВтЕУCO2(g)КЭCH3OH(g)ХЈЖШЫцЪБМфБфЛЏШчЭМЫљЪО:

ЃЈ1ЃЉИУЗДгІЕФЦНКтГЃЪ§KБэДяЪНЮЊ___________ЁЃ
ЃЈ2ЃЉ0~10minЪБМфФкЃЌИУЗДгІЕФЦНОљЗДгІЫйТЪv(H2O)=_______________ЃЌH2ЕФзЊЛЏТЪЮЊ_____________ЁЃ
ЃЈ3ЃЉЯТСаа№ЪіжаЃЌФмЫЕУїЗДгІвбДяЕНЛЏбЇЦНКтзДЬЌЕФЪЧ______(ЬюзжФИ)ЁЃ
A.ШнЦїФкCO2ЁЂH2ЁЂCH3OHЁЂH2O(g)ЕФХЈЖШжЎБШЮЊ1:3:1:1
B.v(CO2)е§:v(H2)Фц=1:3
C.ЦНКтГЃЪ§KБЃГжВЛБф
D.ЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПБЃГжВЛБф
ЃЈ4ЃЉвбжЊдкГЃЮТГЃбЙЯТ:
Ђй2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(l) ЁїH1 =-1452.8kJЁЄmol-1
Ђк2CO(g)+O2(g)=2CO2(g) ЁїH2 =-566.0kJЁЄmol-1
аДГіМзДМВЛЭъШЋШМЩеЩњГЩвЛбѕЛЏЬМКЭвКЬЌЫЎЕФШШЛЏбЇЗНГЬЪН:____________________________ЁЃ
ЃЈ5ЃЉжаЙњПЦбЇдКГЄДКгІгУЛЏбЇбаОПЫљдкМзДМШМСЯЕчГиММЪѕЗНУцЛёЕУаТЭЛЦЦЃЌзщзАГіСЫздКєЮќЕчГиМАжїЖЏЪНЕчЖбЁЃМзДМШМСЯЕчГиЕФЙЄзїдРэШчЯТЭМЫљЪО:

ЂйИУЕчГиЙЄзїЪБЃЌcПкЭЈШЫЕФЮяжЪЮЊ_____________ЁЃ
ЂкИУЕчГиИКМЋЕФЕчМЋЗДгІЪНЮЊ______________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
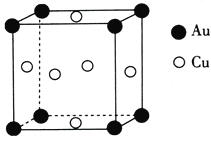
ЁОЬтФПЁПЭЕФЯрЙиЛЏКЯЮядкЩњВњЩњЛюжаОпгаживЊЕФзїгУЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЭдЊЫидкжмЦкБэжаЕФЮЛжУЪЧ______________ЃЌЛљЬЌЭдзгжаЃЌКЫЭтЕчзгеМОнзюИпФмВуЕФЗћКХЪЧ_________________ЃЌеМОнИУзюИпФмВуЕФЕчзгЪ§ЮЊ__________________ЁЃ
ЃЈ2ЃЉдквЛЖЈЬѕМўЯТЃЌН№ЪєЯрЛЅЛЏКЯаЮГЩЕФЛЏКЯЮяГЦЮЊН№ЪєЛЅЛЏЮяЃЌШчCu9Al4ЁЂCu5Zn8ЕШЁЃФГН№ЪєЛЅЛЏЮяОпгаздЗЖадЃЌдзгдкШ§ЮЌПеМфРяГЪжмЦкадгаађХХСаЃЌИУН№ЪєЛЅЛЏЮяЪєгк__________(ЬюЁАОЇЬхЁБЛђЁАЗЧОЇЬхЁБ)ЁЃ
ЃЈ3ЃЉЭФмгыРрТБЫи[(SCN)2]ЗДгІЩњГЩCu(SCN)2ЃЌ1mol(SCN)2ЗжзгжаКЌгаІвМќЕФЪ§ФПЮЊ______________ЁЃ (SCN)2ЖдгІЕФЫсгаСђЧшЫс(H-S-C![]() N)ЁЂвьСђЧшЫс(H-N=C=S)СНжжЁЃРэТлЩЯЧАепЗаЕуЕЭгкКѓепЃЌЦфдвђЪЧ____________________________ЁЃ
N)ЁЂвьСђЧшЫс(H-N=C=S)СНжжЁЃРэТлЩЯЧАепЗаЕуЕЭгкКѓепЃЌЦфдвђЪЧ____________________________ЁЃ
ЃЈ4ЃЉЭОЇЬхжаЭдзгЕФЖбЛ§ЗНЪНЮЊУцаФСЂЗНЖбЛ§ЃЌУПИіЭдзгжмЮЇОрРызюНќЕФЭдзгИіЪ§ЮЊ________ЁЃ
ЃЈ5ЃЉЭгыН№аЮГЩЕФН№ЪєЛЅЛЏЮяЕФОЇАћНсЙЙШчЭМЫљЪОЃЌЦфОЇАћБпГЄЮЊa nmЃЌИУН№ЪєЛЅЛЏЮяЕФУмЖШЮЊ____________(гУКЌaЁЂNAЕФДњЪ§ЪНБэЪО)gЁЄcm-3ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЛњЮяMЮЊКЃбѓЬьШЛВњЮя(вЛ)-PavidolideBВЛЖдГЦШЋКЯГЩЕФжаМфЬхжЎвЛЃЌНсЙЙМђЪНШчЯТЭМЁЃЯТСагаЙиMЕФЫЕЗЈВЛе§ШЗЕФЪЧ

A. ЗжзгЪНЮЊC10H14O
B. ПЩЗЂЩњШЁДњЗДгІМгГЩЗДгІЁЂОлКЯЗДгІ
C. ЗжзгжаЫљгаЬМдзгЖМдкЭЌвЛЦНУцЩЯ
D. БНЛЗЩЯСЌга-OHКЭ-C4H9ЕФMЕФЭЌЗжвьЙЙЬхга12жж
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯЭЈЙ§ЕчЛЏбЇдРэдкТСЦЌБэУцаЮГЩбѕЛЏФЄРДЬсИпЦфПЙИЏЪДФмСІЃЌЙЄзїдРэШчЯТЭМЫљЪОЁЃСаЫЕЗЈе§ШЗЕФЪЧ
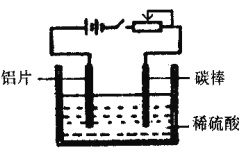
A. ЬМАєПЩгУШЮвтН№ЪєДњЬцЃЌЦфзїгУЪЧДЋЕнЕчСї
B. ЭЈЕчвЛЖЮЪБМфКѓЃЌШмвКЕФpHдіДѓ
C. ЭЈЕчКѓЕчзгБЛЧПжЦДгЬМАєСїЯђТСЦЌЪЙТСБэУцаЮГЩбѕЛЏФЄ
D. ПЩЭЈЙ§ЕїНкЛЌЖЏБфзшЦїРДПижЦбѕЛЏФЄЕФаЮГЩЫйЖШ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com