
【题目】下图转化关系中的m、n、p、q均含氯元素的常见物质,其中p、q为酸,n为单质,下列叙述不正确的是( )
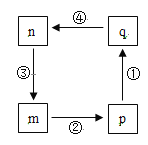
A. n在标况下的密度约为3.17 g·L-1
B. 反应③中物质n与电子转移的物质的量相等
C. p氧化性强于q
D. 四步反应均为氧化还原反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】药物Q适用于治疗高血压、心绞痛,可由有机物P和L制备。
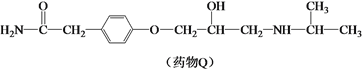
(1)有机物P的合成路线如下。

已知:![]() (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)
① A的分子式为C3H8O,其所含的官能团是_______。
② B的核磁共振氢谱只有一个吸收峰,其结构简式是_______。
③ 由D生成有机物P的反应类型是_______。
(2)有机物L的合成路线如下。
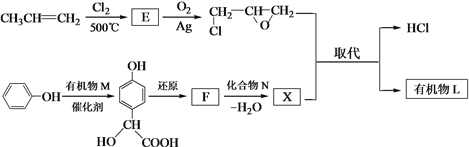
已知:![]()
① 生成E的化学方程式是_______。
② ![]() 与有机物M发生加成反应, M的结构简式为_______。
与有机物M发生加成反应, M的结构简式为_______。
③ F含羧基,化合物N是_______。
④ 生成有机物L的化学方程式是_______。
(3)以![]() 为起始原料合成聚合物甲的路线如下:
为起始原料合成聚合物甲的路线如下:
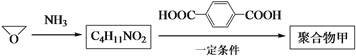
写出聚合物甲的结构简式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是
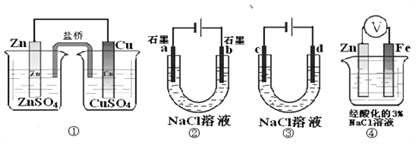
A. 装置①中,盐桥中的Cl-移向CuSO4溶液
B. 装置②工作一段时间后,a极表面生成了较多的O2
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,Zn极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(![]() )是一种高效消毒剂,常用于环境消毒杀菌,可以迅速杀死多种微生物。它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
)是一种高效消毒剂,常用于环境消毒杀菌,可以迅速杀死多种微生物。它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水。
②不断搅拌并控制B中混合液的温度为20~30℃至反应结束。
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品。
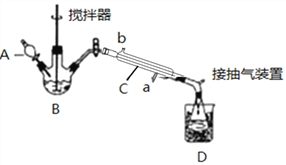
请回答下列问题:
(1)仪器C的名称是_______________;仪器C中冷水流入口是_____(填a或b);
(2)为更好地控制反应温度,应采用方法是_________________;
(3)生成过氧乙酸的化学方程式为________________________________________;
(4)不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见下表),由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是______,反应所需时间约________(选填1、3、5、7)小时;
反应物比例CH3COOH/H2O2 | 反应时间(小时) | ||||
0.5 | 1 | 3 | 5 | 7 | |
2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(5)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率;可供选择的试剂和主要器材有:a.过氧乙酸溶液、b.1mol/L的FeCl3溶液、c.0.5mol/L的Fe2(SO4)3溶液、d.0.5mol/L的CuCl2溶液、e.1mol/L的CuSO4溶液、f.计时器、g.测量气体体积的针筒、i.带导气管的试管。
你选择的试剂及器材是a、_______、f、g、i(选填序号),实验方案是_________________________。
(6)碘量法分析:取2.00mL过氧乙酸试样稀释成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
A. ![]() 、
、 ![]() 是质量数和电子数相等的两种微粒,中子数也相等
是质量数和电子数相等的两种微粒,中子数也相等
B. ![]() 原子的质子数与中子数差50
原子的质子数与中子数差50
C. 35Cl和37Cl两者互为同位素
D. 当氘原子转变为氕原子发生了分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的叙述中,错误的是
A.单质硅是良好的半导体材料
B.硅和碳是都是第ⅣA族的元素
C.二氧化硅用来制造通讯材料(光导纤维)
D.二氧化硅溶于水生成硅酸,它是挥发性酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)![]() 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4容易与H+反应产生氢气而成为储氢材料研究的热点。以硼酸为原料制备NaBH4的一种工艺流程如下图所示:
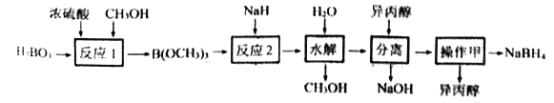
已知: ①H3BO3电离:H3BO3+H2O![]() [B(OH)4]-+H+
[B(OH)4]-+H+
②反应1: H3BO3+3CH3OH![]() B(OCH3)3+3H2O
B(OCH3)3+3H2O
③反应2:B(OCH3)3+4NaH= NaBH4+ 3CH3ONa
(1)H3BO3是____元酸,NaH的电子式为_______________。
(2)NaBH4与水剧烈反应放出H2。反应的化学方程式为________________。
(3)反应1属于______(填有机反应类型),反应过程中蒸出B(OCH3)3的目的是__________。
(4)“水解”时产生的大量NaOH,减缓了NaBH4与水的反应。在该步骤中,与水反应生成大量NaOH的物质是_________。
(5)“分离”后得到NaBH4的异丙醇溶液。操作甲是_____________。
(6)上述流程中可以循环使用的物质是____________。
(7)以惰性电极电解Na[B(OH)4]与NaOH 混合溶液也能制得NaBH4。阴极的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com