
| X | Y | Z | |
| W |
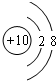 ,故答案为:
,故答案为: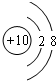 ;
;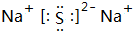 ,故答案为:
,故答案为: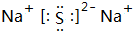 ;
;

科目:高中化学 来源: 题型:
| A、在常温常压下,11.2 升氯气含有的分子数为0.5NA |
| B、在常温常压下,1摩尔气体含有的原子数为NA |
| C、32 g氧气所含原子数目为2NA |
| D、在同温同压下,相同体积的任何气体单质所含原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
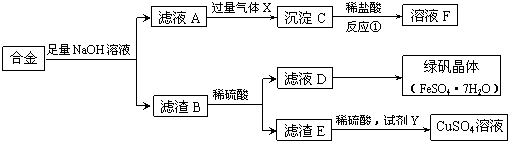
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | 离子浓度关系 | |
| A | pH<7 | c(CH3COO-)>c(CH3COOH) |
| B | pH>7 | c(CH3COO-)<c(CH3COOH) |
| C | pH=7 | c(CH3COO-)=c(CH3COOH) |
| D | pH<7 | c(CH3COO-)<c(CH3COOH) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
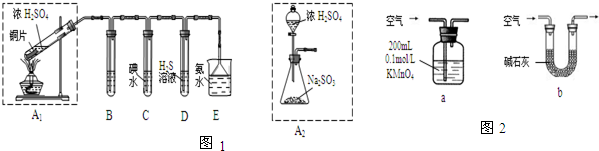
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自然界“水滴石穿”的主要原因用方程式表示为:CaCO3+H2O+CO2═Ca(HCO3)2 |
| B、“雨后彩虹”是与胶体、光学等知识有关的自然现象 |
| C、人类目前直接利用的能量大部分是由化学反应产生的 |
| D、“生物固氮”是指植物通过叶片直接吸收空气中的氮气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
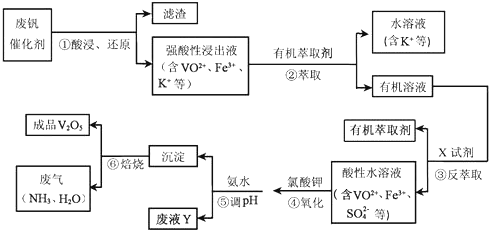
| Ph | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/ | 88 | 92 | 93 | 95 | 95 | 95 | 93 | 90 | 87 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com