
 2C(g)����H��Q kJ/mol���ش��������⣺
2C(g)����H��Q kJ/mol���ش��������⣺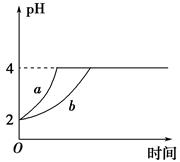
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
 2C(g)��ƽ�����ʽΪK=c2��C��/c3��B��c��A����
2C(g)��ƽ�����ʽΪK=c2��C��/c3��B��c��A����


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2C��g�������ݻ�Ϊ1L���ܱ������м���0.050 mol A��0.025mol B����500��ʱ��ַ�Ӧ����ƽ�����c��C��="0.040" mol��L-1���ų�����Q1kJ��
2C��g�������ݻ�Ϊ1L���ܱ������м���0.050 mol A��0.025mol B����500��ʱ��ַ�Ӧ����ƽ�����c��C��="0.040" mol��L-1���ų�����Q1kJ��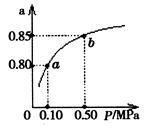
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
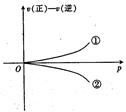
A��2SO3(g)  2SO2(g)+02(g) 2SO2(g)+02(g) |
B��H2(g)+I2(g)  2HI(g) 2HI(g) |
C��C(s)+H2O(g)  C0(g)+H2(g) C0(g)+H2(g) |
D��N2(g)+3H2(g)  2NH3(g) 2NH3(g) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2G(g)�����Թ��������ƽ��ʱG���������(%)���¶Ⱥ�ѹǿ�ı仯���±���ʾ��
2G(g)�����Թ��������ƽ��ʱG���������(%)���¶Ⱥ�ѹǿ�ı仯���±���ʾ��| ѹǿ/MPa �������/% �¶�/�� | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
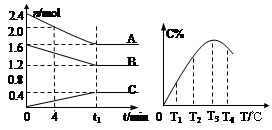
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������أ�KMnO4����Һ��ˮϡ�ͺ���ɫ��dz |
| B��ʹ�ô�������ߺϳɰ�������Ч�� |
| C�����Ƶ���ˮ�ڹ�����������ɫ��dz |
| D��H2��I2��HIƽ���������ѹ����ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
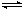 2Z(g) �˷�Ӧ�ﵽƽ��ı�־��
2Z(g) �˷�Ӧ�ﵽƽ��ı�־��| A������Ӧ���淴Ӧ�����ʶ�Ϊ�� | B�������ڸ����ʵ�Ũ�Ȳ���ʱ��仯 |
| C��������X��Y��Z��Ũ��֮��Ϊ1��2��2 | D����λʱ������0.1molXͬʱ����0.2molZ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Fe(s)+ CO2(g) ��H>0
Fe(s)+ CO2(g) ��H>0�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com