
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
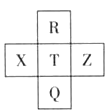
A. T的单质在化学反应中只表现氧化性
B. R与Q的电子数相差16
C. T形成的含氧酸的酸性一定比X形成的含氧酸强
D. 在这五种元素中Z的化学性质最稳定
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.3.2 g臭氧中含有的氧原子数为0.2NA
B.0.1 mol苯中含有的碳碳双键数目为0.3NA
C.1 L 0.1 mol/LCH3COOH溶液中含有的氢原子数为0.1NA
D.标准状况下,22.4 L盐酸中含有的HC1分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中,产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
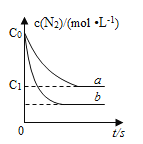
A.温度T下,该反应的平衡常数K=![]()
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①反应速率最大的时间段是(指0~1、1~2、2~3、3~4、4~5 )____min,原因是_________________。
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率________________。(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列__________以减慢反应速率。(填写代号)
A.蒸馏水 B.冰块 C.HNO3溶液 D.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图。

①该反应的化学方程式是________。
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率=(转化的物质的量/初始物质的量)×100%】,请写出计算过程,计算结果保留1位小数)________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数为2 NA
B. 0.1 mol/L (NH4)2SO4溶液与0.2 mol/L NH4Cl溶液中的NH4+数目相同
C. 标准状况下,H2和CO混合气体8.96 L在足量O2中充分燃烧消耗O2分子数为0.2 NA
D. 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-的物质的量最多的是( )
A.200mL 2mol/L MgCl2溶液
B.150mL 5mol/L KClO3溶液
C.标准状况下,13.44L的HCl气体
D.29.25gNaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在陶瓷器皿表面的釉质中含有极微量的Pb、Cd、Sb等有毒金属盐类,为防止中毒,不能长期盛放下列物质的是( )
A. 食盐 B. 酱油
C. 蔗糖 D. 食醋
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密度为0.910 g·cm-3的氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是( )。
A. 溶液的pH增大 B. 溶液中的Zn2+浓度增大
C. 溶液中的SO![]() 浓度增大 D. 溶液的密度增大
浓度增大 D. 溶液的密度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com