
【题目】将40℃时的饱和KCl溶液冷却至10℃,该过程中保持不变的是
A. KCl的溶解度 B. 溶剂的质量 C. 溶质的质量分数 D. 溶液中K+的数目
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
Ga和As在材料科学领域用途广泛。请回答下列问题:
(1)基态Ga原子价层电子的轨道表达式为_________;其核外电子占据最高能级的符号为___________。
(2)GaAs是优良的半导体材料,晶胞结构与金刚石相似。该晶体中不含有的化学键类型
为___________(填选项字母)。
A.σ键 B.π键 C.配位键 D.金属键
(3)Ga、N、As的合金材料是制作太阳能电池的重要原料,三种基态原子的第一电离能由小到大的顺序为________________________(用元素符号表示)。
(4)AsH3的立体构型为___________。相同压强下,AsH3的沸点低于NH3的原因为___________。
(5)LiZnAS基稀磁半导体晶胞如图所示,该晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA。则:

①与Li原子距离最近且相等的Zn原子的数目为____________。
②晶胞参数a =_____________pm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C三种有机物的有关信息。
A | B | C |
能使溴的四氯化碳溶液褪色;比例模型为
| 由C、H、O三种元素组成 ②球棍模型为 | ①由C、H、Br三种元素组成②相对分子质量为151 |
(1)A与氢气发生加成反应后生成分子D,在D的同系物中,当碳原子数n=________时,这类有机物开始有同分异构体。
(2)B与浓溴水反应的化学方程式为___________________________________
(3)若C分子中含有3个甲基,则有机物C的结构(不考虑立体异构)有_________种,其中核磁共振氢谱有3组峰,且峰面积之比为6:3:2的结构简式为 _______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香精P是工业中一种重要的有机原料,其合成路线如图所示
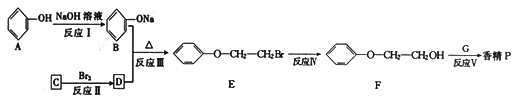
已知:①G的结构简式为CH2=CH—CH2—COOH
②R—ONa![]() R—O—R’(—R、—R’代表烃基)
R—O—R’(—R、—R’代表烃基)
(1)F中所含官能团的名称为__________________
(2)1mol香精P与足量氢气反应,最多消耗__________ mol氢气。
(3)反应Ⅱ的反应类型为__________________,反应Ⅳ的条件是____________________
(4)反应V的化学方程式为_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应其△H=﹣198kJmol﹣1,△S=348Jmol﹣1K﹣1,则此反应在下列哪种情况下可自发进行( )
A.仅在低温下自发进行B.仅在高温下自发进行
C.在任何温度下都不能自发进行D.在任何温度下都能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液.下列说法中正确的是( )
A. 若c1=2c2,则w1<2w2,V<50 mL
B. 若c1=2c2,则w1<2w2,V>50 mL
C. 若w1=2w2,则c1<2c2,V=50 mL
D. 若w1=2w2,则c1>2c2,V<50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 在用水吸收HCl气体时可把导管直接插入液面下
B. 稀释浓硫酸时,常把水加入到盛浓硫酸的烧杯中
C. 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片
D. 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,先停止通CO,再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A. 1/2N2H4(g)+1/2O2(g)===1/2N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B. N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH =-534 kJ·mol-1
C. N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH =-534 kJ·mol-1
D. N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH =-133.5 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com