
【题目】合乎实际并用于工业生产的为( )
A.氢气和氯气混合光照制氯化氢B.金属钠在氯气中燃烧制氯化钠
C.氯气通入澄清石灰水中制漂白粉D.高温分解石灰石制生石灰
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,电池反应如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2放电时是电池的负极,充电时是电池的阳极
B. 负极的电极反应式为:Pb + SO42—– 2e–=PbSO4
C. 放电时,PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业氧化铍可生产金属铍、制作铍合金及特殊陶瓷。由绿柱石(含3BeO·Al2O3·6SiO2及铁等微量元素)和方解石(主要成分是CaCO3)为原料生产氧化铍的工艺流程如下:

已知:Be与Al性质相似。下列叙述错误的是
A. “浸渣”受热后的主要成分是SiO2和CaSO4
B. 利用“碱溶渣”可回收金属铁
C. “水解,调节pH”反应的主要离子是BeO22-
D. 上述流程中“碱、水”宜使用廉价的氨水,降低生产成本
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(LiNi1-x-y) Cox MnyO2)的工艺流程如下:

回答下列问题:
(1)能够提高碱浸效率的方法有___________(至少写两种)。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是__________。
(3)LiCoO2中Co元素化合价为_____,其参与“还原”反应的离子方程式为_____________。
(4)溶液温度和浸渍时间对钻的浸出率影响如图所示:

则浸出过程的最佳条件是__________。
(5)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,列式计算Co2+沉淀完全时溶液的pH______________(已知离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=2.0×10-15,1g2=0.3,溶液体积变化忽略不计)
(6)写出“高温烧结固相合成”过程的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将甲烷和二氧化碳一步转化为具有高附加值的液体燃料和化工产品。回答下列问题:
(1)已知:甲烷和乙酸的燃烧热△H分别为-890.31kJ·mol-1、-876.72kJ·mol-1,试写出甲烷与CO2合成乙酸的热化学方程式:______________。
(2)甲烷和二氧化碳一步转化为液体产品的选择性如下图所示,其中选择性最高的产品是___________,反应中应加入的等离子体催化剂是___________。

(3)在某一钢性密闭容器中CH4、CO2的分压分别为25kPa、30kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率υco=1.28×10-2·p(CH4)·p(CO2) (mol·g-1·s-1),某时刻测得p(H2)=20kPa,则p(CH4)= ____kPa,υco=___mol·g-1·s-1。
②达到平衡后测得体系总压是起始时的1.8倍,则该反应的平衡常数Kp=________(kPa)2(计算结果保留两位有效数字)。
③温度对产物流量及平衡转化率的影响如图所示,可知反应△H____0(填“>”或“<”),原因是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碳酸钠晶体(Na2CO310H2O)配制 0.1mol/L 的碳酸钠溶液,正确的方法是
A. 称量 10.6g 碳酸钠晶体,溶解在 1L 水中
B. 称量 28.6g 碳酸钠晶体,溶解在 1L 水中
C. 称量 14.3g 碳酸钠晶体,溶解在适量水中,然后在容量瓶中加水到 1L
D. 称量 14.3g 碳酸钠晶体,溶解在适量水中,然后在容量瓶中加水到 500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁((C6H11O7)2Fe)是常用的补铁剂,易溶于水,几乎不溶于乙醇。用下图装置制备FeCO3,并利用FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:
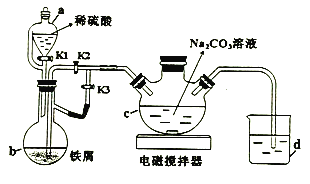
(1)a的名称为_________。
(2)打开a中K1、K3,关闭K2,一段时间后,关闭K3,打开K2。在_________(填仪器标号)中制得碳酸亚铁。实验过程中产生的H2作用有_________、____________。(写2条)
(3)将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色。用化学方程式说明原因____________。
(4)将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是_________________。
(5)用 NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,离子方程式为______________,此法产品纯度更高,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)作为一种非常有前景的储氢材料,近年来日益受到人们的重视。氨硼烷(NH3·BH3)电池可在常温下工作,装置如下图所示。该电池的总反应为:NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是( )

A. 右侧电极发生氧化反应 B. 电池工作时,H+通过质子交换膜向左侧移动
C. 负极的电极反应式为H2O2+2H++2e-=2H2O D. 每消耗31g氨硼烷,理论上应转移6mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com